| |
|
| Report of the Subcommittee on Anatomy, Physiology, and Pathophysiology of the Meibomian Gland |
Erich Knop, 1 Nadja Knop, 1 Thomas Millar, 2 Hiroto Obata, 3 and David A. Sullivan 4,5 |
|
マイボーム腺(瞼板腺)は、眼瞼にある大型の脂腺であり、皮膚の脂腺とは異なり毛髪に付属してい ない。 Duke-Elder と Wyler 1 によると、マイボーム腺の最初の記述は起源 200 年のガレノスによるものだが、後 の 1666 年にドイツ人の医師および解剖学者であったハインリヒ・マイボーム( Heinrich Meibom )が記載したことから、この名がついた。
マイボーム腺が産生する脂質は涙液層表層の油層の主要成分であり、水層の蒸発を防いでおり、 また 、表面張力を下げることで涙液層を安定化しているとも考えられている 2 。このように、マイボーム腺の脂質は眼表面の健康と完全性を維持するのに不可欠なものである。
マイボーム腺は通常の皮脂腺と基本的な特徴は共通 している が、 解剖 、存在 位置 、分泌制御、分泌物の成分構成および機能にいくつか明確な違いがある。
日ではマイボーム腺機能不全( MGD ) 3 と呼ばれているマイボーム腺の機能障害は、独立したひとつの病態としての認識が強まりつつある 4-8 。ドライアイ患者では、 MGD であることを示す油層の変化が見られる割合が、水層単独の変化よりも多いことが報告されている。 Heiligenhaus ら 9 の研究によれば、ドライアイ患者において脂質の減少があった者が 76.7 %いたのに対し、水層単独の変化があった者は 11.1 %しかいなかった。この結果と同様の知見が、 Shimazaki ら 10 による観察で得られている。それによると、ドライアイ症状で定義される眼不快感を伴う眼の絶対多数が MGD を有していた。この観察結果によれば、こうした眼全体のうち 64.6 %および涙液水層分泌減少型を除いた眼の 74.5 %に閉塞性 MGD や腺組織の脱落が見られた 10 。 Horwath-Winter ら 11 は、ドライアイ患者の 78 %、または非シェーグレン症候群患者のみを考慮する場合には 87 %の患者に MGD が合併したが、対して涙液水層減少単独は 13% の患者にしか見られなかった。このことから、 MGD は常に過小評価されぎみだが重要な病態であり、
涙液水層の蒸発量が増加するために、 ドライアイ 疾患のもっとも多い原因である可能性がある 5,9-12 。
これまでの MGD に関するいくつかの 優れた総説 4,7,8,13,14 を経て 、近年ではたくさんの新たな知見が報告されているが、別の疑問が 浮かび上がって 未解決のままにある。マイボーム腺が機能不全や疾患に至るための条件を理解するためには、マイボーム腺の構造と機能および眼表面の機能的解剖におけるマイ ボーム腺の役割 15 に関する確かな理解が必要である。そこで、我々はマイボーム腺の生理学的 な面 と病態生理学的な面に対して包括的なレビューを提供することを目指した。
ハインリヒ・マイボーム
ハインリヒ・マイボーム( Heinrich Meibom 、 1638-1700 、 Fig.1 ) 16 は、学者一家の家に生まれた。父親のヨハン・ハインリヒ・マイボームは医師であり、祖父のハインリヒ・マイボーム( 1555-1625 )はドイツ歴史学者かつ詩人で 17 、ヘルムシュテット大学の歴史学と詩学の教授であった。孫のハインリヒ・マイボームは 1638 年 6 月 29 日に ドイツの リューベックで生まれ、その後はヨーロッパ中を旅して、国際人教育を受けた。 1938 年に British Medical Journal は彼の生誕 300 周年を記念する短い記事 18 の中で、彼のことを次のように記している。「同時代人の多くと同じく、彼もまた文化、詩、修辞、医術の神であるアポロの真の申し子であった。 1663 年にアンジェーでまだ医学生だった時に( 1663 年に医師学位を取得)、すでに彼はヘルムシュテット大学の医学部教授に指名され、 1664 年にその地位に就いた。その 14 年後には、 さらに 歴史学と詩学の教授の任にも就いた。また、本業以外の趣味の分野である考古学、文献学、哲学においても万能ぶりを発揮し、生涯を通じて飽くことない知的冒 険者であった。」明らかに多才な人物であり、医学部教授に就いてから間もない 1666 年に、ハインリヒ・マイボームは瞼板の内部にある脂腺についての初めての詳しい記述を、その図も含めて論文で発表した。これが後にマイボーム腺と呼ばれる ようになった腺である。彼の記述は、 "De Vasis Palpebrarum Novis Epistola" 19 という 題名で 書籍の形で出された。これに 掲載されていた 当初の図には、瞼板の全長に渡って走る複数の個別の腺で眼瞼縁に開口するというこの腺の基本的な特徴が示されており、 この特徴は、かなり 後 に発表された別の有名な 図( Fig.2 ) と 類似する が、細部では異なっているところもあった。
解剖学、発生学、生理学
マイボーム腺の解剖学
配置 1 個のマイボーム腺は、分泌腺房の集合で構成されており、分泌腺房は長い中央導管の周りを取り囲んでいて、短い小導管で連結している。この配置は、吊るしたタマネギ の鎖に例えられる 20 。中央導管の一端は盲端になっており、もう一端は眼瞼縁において瞼縁後部近く、粘膜皮膚移行部のすぐ前方に開口していて、脂質性分泌物を涙液メニスカスに供給している 21 。 |

FIGURE 1. Heinrich Meibom, the younger (1638–1700). In 1666, he published the first detailed description of the tarsal glands in the eyelid, which later became known as the meibomian glands. Reprinted with permission of the Herzog August Bibliothek, Wolfenb ü ttel , Germany , Signatur B 100.
|
これらの個々の腺は、上眼瞼と下眼瞼の瞼板の全長に渡って 1 列に並行に並んでおり 1,22,23 、おそらくホルモンと神経による制御および瞬目の際の筋収縮の機械的な力によって協調して働いていると考えられている。 24
マイボーム腺が存在する範囲は、上眼瞼と下眼瞼の瞼板の大きさにほぼ一致している。したがって、上眼瞼と下眼瞼では違いがある( Fig.2 )。上眼瞼の瞼板は半円形をしており、中央部が上方におよそ 1 cm の幅に広がっており、耳側と鼻側が狭くなっている。対して下眼瞼の瞼板は、もっと小形であり、鼻側から耳側にかけてだいたい同じ広さ(〜 0.5 cm )の帯状をしている。 24
腺の大きさと数 報告されているマイボーム腺の大きさは、それぞれの研究でかなり差がある。上眼瞼での腺の 数は、ある研究 20 では 25 個で、別の研究 1 では 40 個であり、中央値はおよそ 31 個である 25 。下眼瞼の腺の数は上記の前者の研究 20 では 20 個、後者の研究 1 では 30 個であり、中央値はおよそ 26 個である 25 。個々の線の長さは、上眼瞼中央部でおよそ 5.5 mm 、下眼瞼でおよそ 2 mm と報告されており、したがって計算による総体積も、上眼瞼( 26 μL )が下眼瞼( 13 μL )のおよそ 2 倍になる 25 。下眼瞼のマイボーム腺は上眼瞼のものより太い傾向がある。 1 つのマイボーム腺に属する分泌腺房の数は、およそ 10 個から 15 個と報告されており 20 、やはり上眼瞼のほうが下眼瞼より多い傾向がある。
したがって、上眼瞼のマイボーム腺の分泌能力は下眼瞼のおよそ 2 倍になるはず である。しかし、大半の研究は 下眼瞼を対象にしている 。これは 下眼瞼 の方が はるかに調べやすい ためである 。上眼瞼と下眼瞼の分泌能力の比較はまだ研究されたことがない。
マイボーム腺の 胚発生
マイボーム腺の胎生期での成長は、胎生 3 ヶ月から 7 ヶ月にかけて起こる。この時期は眼瞼発生における瞼密閉期にあたる 26-28 。この時期、眼瞼ひだ内の中胚葉からの疎な結合組織が瞼板と筋(眼輪筋とリオラン筋)、血管、 および 眼瞼外表面の皮膚および結膜の下に位置する疎な結合組織に分化する。マイボーム腺の原基(器官発生の土台となる胚細胞が最初に集まったもの)からのマイ ボーム腺の発生は、毛原基からの毛包の発生にきわめてよく似ている。いずれも癒合した眼瞼ひだを閉鎖して中胚葉を閉じこめている外胚葉シートから成長す る。しかし、 Ehler のグループ 28 の詳しい研究にあるように、マイボーム腺のほうが大型かつ深く成長し、発生完了までの時間が長くかかる。
分泌腺( 全分泌型 皮脂腺であるツァイス腺と汗腺が変化したモル腺)を伴う睫毛の毛原基と同様に、マイボーム腺原基の上皮索が外に向けて増殖し、それが後に連結小導管と全分 泌型皮脂腺の腺房に分化する。マイボーム腺原基の上皮柱の内部では、毛原基と同様に脂質の産生によって中心管腔が形成され、それが後に中央導管になる。脂 質の産生に続き、管腔の上皮細胞にケラトヒアリン顆粒が現われ始めるので、脂質合成と角化の変化はなんらかの関係があるものと想定されている 28 。より成熟したマイボーム腺原基と睫毛のツァイス腺による脂質産生は、閉鎖された 2 つの眼瞼ひだの間での管腔形成にも関係があることが分かっており、この脂質産生に |

FIGURE 2. Topography of the meibomian glands within the tarsal plates of the upper and lower eyelids. The extension of a single meibomian gland follows the shape of the tarsal plate, which is different in both lids. The drawing depicts a posterior view with the anterior part of the lid removed, and the tarsal connective tissue made translucent so that the glands are exposed. The proximal ends of the glands extend toward the proximal margin of the tarsal plates and the secretum (meibum) is delivered at the distal end of the tarsus via a short excretory duct through the orifice onto the lid margin. Reproduced from Sobotta Ð. Atlas der Anatomie des Menschen. Ferner H, Straubesand J, eds. Ed. 18, Vol. 1, p. 215, Urban & Schwarzenberg 1982, with the kind permission of Elsevier.
|
により上眼瞼と下眼瞼の開裂がもたらされ、そして胎生 7 ヶ月の時に上下の眼瞼に完全に分化する 28 。マウスでは、脂質分泌よりも角化の量の増加のほうが上下眼瞼の開裂に関与していると考えられている 29 。
以上のように、発生段階のマイボーム腺の中央導管は睫毛の毛包に比することができ、成人における角化 の状態など、構造や上皮分化においても明白な類似性が見てとれる。したがってマイボーム腺は、「毛幹のない毛包」であるということができる 30 。こうした観察知見に基づき、過角化はマイボーム腺の典型的な疾患であると結論づけることができる。
マイボーム腺の組織像
イボーム腺は、分泌腺房が小径の小導管を介して大径でまっすぐ長い中央導管に連結している構造をして おり( Fig.3 )、中央導管は瞼板の全長に渡って延びていて、眼瞼自由縁の瞼縁後部のすぐ前方に開口している。導管系全体の内面は角化初期の特徴を持つ重層扁平上皮で覆 われている。管腔内の角化層の存在で示される完全な角質化(角化)は、 |
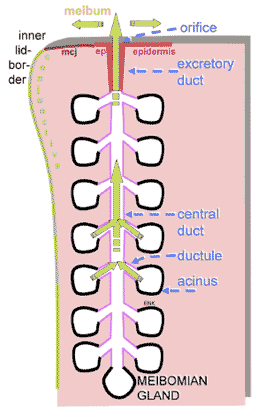
FIGURE 3. Morphology of a single meibomian gland. A single meibomian gland (located within the tarsal plate near the conjunctiva) is composed of multiple holocrine secretory acini that are arranged circularly around a long central duct to which they are connected via short, lateral, connecting ductules. The terminal part of the central duct is lined by an ingrowth of the epidermis (ep) that covers the free lid margin and hence forms a short excretory duct that opens as an orifice at the posterior part of the lid margin just anterior to the mucocutaneous junction (mcj) near the inner lid border. The oily secretum (meibum) is synthesized within the secretory acini and transported ( yellow arrows ) in a distal direction toward the orifice. Knop N, Knop E. [Meibomian glands. Part I: anatomy, embryology and histology of the Meibomian glands] Meibom-Drüsen Teil I: Anatomie, Embryologie und Histologie der Meibom-Drüsen. Ophthalmologe . 2009;106:872–883, with the kind permission of Springer Science and Business Media. |
正常では中央導管の終端部分にしか存在しない。導管のこの部分は、眼瞼自由縁の表面から角化表皮が増殖して内面を覆っている 1,23,24,31,32 。
腺房 特殊化した皮脂腺であるマイボーム腺の腺房は、全分泌型 の分泌様式を 受け継いで おり、それが構造にも現れている( Fig.4A )。多数ある分泌腺房は膨満して、直径およそ 150 から 200 μm の球状を呈している。腺房の内部は分泌細胞であるマイボーム腺細胞( meibocyte )で隙間なく充填されている 33 。基底細胞はより小さく、濃染する細胞である。マイボーム腺細胞は腺房の中心に近いほうに位置しており、細胞質内に脂質が徐々に蓄積していき、そのため に、パラフィン包埋切片を用いる通常の組織学ではだんだんと泡のように膨らんで細胞内が淡色になっていく過程が見てとれる。これは、標本処理過程で脂質が 脱けてしまうためである。マイボーム腺細胞は成熟の過程において、中心部にある細胞の核が縮んで、圧縮し、分解する(核濃縮)。最後に、細胞が腺房から小 導管に移行する際に細胞膜が壊れる。このようにして細胞の内容物全体が油性の分泌産物を作り、それはマイバム ( meibum ) と呼ばれる 33 。基底層におけるより未分化な未熟細胞にも成熟勾配があるという所見も、マウス 34 とヒト 35 のマイボーム腺で透過型電子顕微鏡によって得られている。基底側の腺房細胞の核は、ヘテロクロマチンに多く含まれ明瞭な核小体を持つ中密度核である。基底 側の腺房細胞は細胞質が少なく、多数のケラチン線維と多数のミトコンドリアと多数の遊離型リボソームを含んでいる。これは細胞内タンパク質合成の特徴であ る。反対に、分泌物の 輸送 に関わる滑面小胞体とゴルジ装置はほとんどない。腺房の周辺にあるマイボーム腺細胞の基底層が、増殖前駆細胞集団を構成しており、その細胞が一貫して新し いマイボーム腺細胞を生み出している。ラットでは、およそ 4 日で新しいマイボーム腺細胞が作られている 36 。
連結小導管 典型的には 1 個、場合によっては複数の腺房が 1 本の小導管につながっている。小導管は長さがおよそ 150 μm 、内径がおよそ 30 から 50 μm ある。小導管の内面は重層( 4 層) の 扁平上皮で覆われている。腺房から小導管の連結部分では、基底マイボーム腺細胞の周辺層が小導管上皮に急に切り替わっていることが、サルとウサギの電子顕 微鏡観察で報告されている 32 。この結論は、隣接するマイボーム腺細胞には脂肪滴があるのに、小導管の上皮細胞にはそれが見られず、代わりにケラトヒアリン顆粒が見られるという観察結 果に基づいている。ヒトのマイボーム腺の組織像では、この領域における上皮細胞の形態と配置に基づいての細胞の急激な切り替わりが必ずしも確認されている わけではない。というのも、ヒトでは明るい色と球形の基底マイボーム腺細胞が、小導管の若干暗い細胞質と長い形態の多層上皮へと徐々に移行する様子が見て 取れるからである( Fig.4B )。正常 なヒト のマイボーム腺の小導管上皮には、ケラトヒアリン顆粒も観察されている( Knop E, et al. IOVS 2009;50:ARVO E-Abstract 4833 )。
中央導管 連結小導管は長い中央導管に、通常は斜めの方向で開口している。角度がついていることから、鋭い組織棘が形成される。この棘は主に上皮細胞で構成されており、中央導管への入口の部分では細い結合組織の芯がはいっている( Fig.4C )。
中央導管は内面がやはり 4 層の重層扁平上皮で覆われているが、内径はずっと大きく、およそ 100 ~ 150 μm ある。中央 導管はそのマイボーム腺の全長に渡って延びており、瞼板の範囲にほぼ一致する 1,20,25,37 。
眼瞼自由縁に近い中央導管の終端部分とその領域の腺房の周囲には、リオラン筋の横紋筋線維が取り囲んでい る( Fig.5 、 Fig.18A も参照)。この筋線維は胎生期において睫毛毛包が瞼板ひだ奥深くに発達することで眼輪筋の線維が分かれたものである。この筋線維は、マイボーム腺の終端付 近を取り囲んでいるように見える 20,38 。排出導管につながる中央導管の終端部分は、若干拡張していることが多く、いわゆる膨大部を形成している。もしかすると、分泌された マイバム の生理的成分のためなのかもしれない。
出導管 眼瞼自由縁の角化上皮(表皮) が伸展 してマイボーム腺の終端部分におよそ 0.5 mm 入り込んでいる 1,22,23,32 。 |
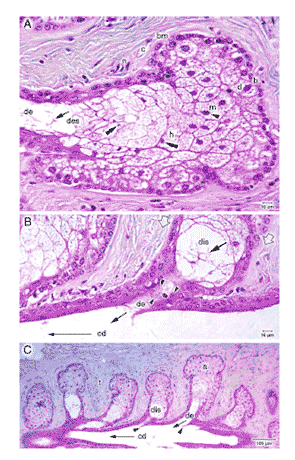
FIGURE 4. Structure of the acini and ductal system of a normal meibomian gland. ( A ) The holocrine acini of the meibomian gland are filled with the secretory cells (meibocytes) and surrounded by a basement membrane (bm). In the periphery of the acinus, a capillary (c) and a small nerve fiber (n) are seen. From the basal cells (b) at the peripheral margin, differentiating meibocytes (d) start with the production and accumulation of lipids within lipid droplets that occur as vacuoles in routine histology, because the lipids are dissolved in the histologic preparation. Toward the center of the acinus, there is an increase in the number and size of their internal lipid droplets as the cells differentiate into mature meibocytes (m). These remain vital, as indicated by their intact nucleus ( arrowhead ). In the very large hypermature meibocytes (h), the nucleus becomes pyknotic ( double arrowheads ) [compare with Fig. 7]. The cytoplasmic membrane of these cells disintegrates, and the components of the whole cell form the secretory product, termed meibum, in the disintegration zone (des) close to the connecting ductule (de). Remnants ( arrow ) of the meibocytes are still found inside the ductule and sometimes in the central duct. ( B ) In the area of the disintegration zone, located at the transition of the acinus to the ductule, the basal cell layer is replaced ( open arrows ) by the multilayered squamous epithelium of the ductule, which is about four cell layers thick. If the ductal epithelium is observed in an oblique plane of section, it is seen to contain keratohyalin granules ( arrowheads ) in the luminal cell layer that represent an incipient stage of keratinization. ( C ) Numerous acini of spherical to elongated shape are radially arranged around the central duct (cd) of a gland, seen here in a longitudinal section. Ductules enter ( B , C , arrows ) the central duct, typically in an oblique direction, which results in the formation of a sharp tissue spur ( C , arrowheads ) toward the central duct. The direction of flow of the meibum inside the gland is indicated by a large arrow in ( B ) and ( C ). Light microscopic images of paraffin-embedded sections stained with hematoxylin and eosin (H&E); size markers are shown in the images. Reprinted from Knop N, Knop E. [Meibomian glands. Part I: anatomy, embryology and histology of the Meibomian glands] Meibom-Drüsen Teil I: Anatomie, Embryologie und Histologie der Meibom-Drüsen. Ophthalmologe . 2009;106:872–883 with the kind permission of Springer Science and Business Media.
|
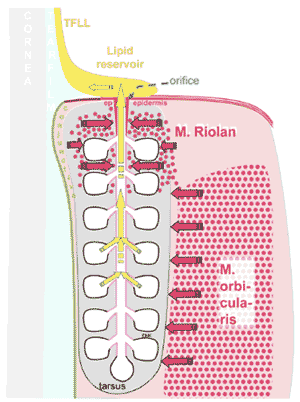
FIGURE 5. Driving forces for the delivery of meibomian oil onto the lid margin and tear film. A schematic drawing of a single meibomian gland inside the connective tissue of the tarsus at the posterior lid margin. The driving forces that result in the eventual delivery of meibomian oil (meibum) onto the lid margin and tear film are (1) the continuous secretion of meibum by the secretory acini, which generates a secretory pressure that pushes the meibum ( yellow arrows ) into the ductal system and further toward the orifice and (2) the mechanical muscular action by muscle fibers ( red dots ) of the pretarsal orbicularis muscle (M. orbicularis), located on the outside of the tarsus, and of the marginal muscle of Riolan (M. Riolan), which encircles the terminal part of the meibomian gland. During a blink, these muscles may exert a compression ( red arrows ) of the meibomian gland that drives the oil out of the orifice into the marginal lipid reservoir, where it eventually constitutes the tear film lipid layer (TFLL), as observed clinically [compare with Figs. 3, 7, and 18]. Reprinted from Knop E, Knop N, Schirra F. [Meibomian glands. Part II: physiology, characteristics, distribution and function of meibomian oil] Meibom-Dr ü sen Teil II: Physiologie, Eigenschaften, Verteilung und Funktion des Meibom- Ö ls. Ophthalmologe . 2009;106:884–892, with the kind permission of Springer Science and Business Media.
|
そこには、多数の濃密なケラトヒアリン顆粒を含む角化細胞(顆粒層)があり、表層は完全に角質化 した(角化)細胞からなる。開口部からおよそ 0.5 mm 入ったあたりで、この上皮は角質層と顆粒層を失い、およそ 6 ~ 8 層あった層数が 4 層に減って、通常のマイボーム腺の導管上皮に徐々に移行していく。この導管終端部の上皮は中央導管のその他の部分とは構造が異なるので、特に排出導管と呼 ぶのが適切であろう( Knop E, et al. IOVS 2009;50:ARVO E-Abstract 4833 )。
マイボーム腺の生理学
分泌様式 マイボーム腺基底細胞は脂質の産生と蓄積といった成熟の過程で、腺房の基底部から腺房 中心へと 36 、そして最後には小導管の入口にまで移動する( Fig.4 、 Fig.3 にも示している)。分泌の過程とその産物の生化学的特徴については、脂質合成の章で考察している。
この過程において、マイボーム腺細胞は Gorgas 34 が記述した複数の構造的特徴に基づいて形態的に区別することができるいくつかの段階(基底、分化、成熟、過熟)を経る。細胞内での脂質産生に必要な細胞小 器官、特に滑面小胞体とペルオキシソームがこの過程の中で数と大きさを増す 34 。脂肪滴が滑面小胞体の多層ラメラ膜構造で包まれる。このラメラ膜は 滑面小胞体 に由来すると考えられている 34 。同様の多層ラメラ膜構造が合わさって脂肪滴になり、それが マイバム の材料となる 35 。脂質、タンパク質、核酸といった細胞内のすべての構成成分も油性分泌産物、すなわち マイバム の材料になる 33 。
導管系は、瞼縁後部に放出される最終分泌産物に対して能動的・受動的に関与していると考えられる。なぜならば ( 1 ) 神経線維が腺房周囲にだけでなく導管系周囲にも観察される 39 ため 、 および ( 2 ) 分泌された元々のマイボーム腺脂質は、少なくともその一部が、導管系に常在する細菌の加水分解酵素によって改変を受け、トリグリセリドが遊離脂肪酸と小型 のモノグリセリドやジグリセリドに分解するなどの変化をすること 40 が、眼瞼炎患者 41 および正常状態でも想定される ため である。眼瞼炎患者から採取された マイバム サンプルのほとんどが常在細菌培養陽性だが 42 、健常者でも同様である。
分泌と排出のメカニズム マイボーム腺は長いので、腺房内における マイバム 分泌過程と、 マイバム の機能が発揮される眼瞼縁への実際の排出との間には、長い距離があることが多い。したがって、 Bron と Tiffany 43 が提唱した用語を用いて、 マイバム の分泌と排出とを区別することが推奨される。
腺房内では新たなマイボーム腺 細胞 の生成と、それが最終分泌産物へとなる崩壊の過程が常に継続しているので、腺の導管系の中にあるマイボーム腺の脂質を眼瞼自由縁に向けて圧し出す力が生ま れる( Fig.3 )。連続産生されるという説の根拠としては、新マイボーム腺細胞 36 の生成間隔の観察データだけでなく、眼瞼を閉じている 睡眠 後の朝には、おそらく導管系内に蓄積した大量の脂質が大量に眼瞼縁に供給されるというデータもある 44,45 。さらに、 マイバム の一定した連続分泌は、閉塞した腺の内圧が亢進するための基盤となる考えである。
同じ観察事実はさらに、 Linton ら 46 が提唱した眼瞼筋の機械的作用が排出に寄与しているという結論を支持している( Fig.5 )。瞬目時の眼瞼運動の際に、瞼板の 表 層に位置する眼輪筋が瞼板とその中に埋まっているマイボーム腺を圧迫する。これによって「搾乳作用で分泌が促進される」と結論づけられた 46 。マイボーム腺は瞼板に埋まっていることから、眼瞼縁方向に沿って同一の作用が個々の腺に対して及ぶと考えられてきた 37 。リオラン筋の収縮は終端部の導管系と腺房を圧迫し、油性の マイバム を眼瞼縁表面に排出するのに役立っていると考えられる。この考えは、眼瞼縁への マイバム の放出が、液状噴出の形であるという偶発的な観察によって支持されている 47 。リオラン筋の収縮は、マイボーム腺の終端部を圧迫して閉鎖させるように働き、流出を止める(すなわち、 マイバムの 流出に関して瞼板前部の眼輪筋とは拮抗的に働く)という説もある 46 。この考えをさらに推し進めると、瞬目運動の時にはリオラン筋が弛緩して眼輪筋が「搾乳作用」を行い、反対に、瞬目間では眼輪筋が弛緩してリオラン筋が収 縮することで マイバム の流出を防いでいると考えられる 46 。 Linton ら 46 が言うように眼輪筋が弛緩していて マイバム に対する圧出作用は行なっていなくとも、リオラン筋の収縮は マイバム の不要な流出(夜間など)を制限するのにも役立っているとも考えられる。こうした推察は マイバム排出 の説明として魅力的だが、リオラン筋が瞼板前部の眼輪筋に対して拮抗的な作用をもつというようなエビデンスはない。また、上下の瞼板筋の平滑筋線維束の影 響または、マイボーム腺機能や マイバム 排出に影響する可能性のある瞼板および眼瞼の成分と形態の加齢性変化や病的変化の影響についてもエビデンスがない。今後の研究が必要である。
一晩中、瞬目と筋作用がない 場合 には、導管系内に蓄積した マイバム が大量に排出される。この作用は、起床後 1 時間くらいの午前中や、臨床的には瞬目回数が減る ような長時間の集中 作業の後 45,46 に マイボメトリー で観察されている 44 。したがって、強制的に瞬目を繰り返すことで涙液油層は有意に厚くなり 48 、そうした運動は閉塞性マイボーム腺疾患の初期患者 に見られる 軽度の閉塞を解消する方法として適切な治療法である 3 。
眼瞼の配置とマイボーム腺の機能 上眼瞼と 下眼 瞼でのマイボーム腺の寄与程度の違いについては、今日まで研究がまだ十分になされていない。計算によるマイボーム腺の容積は上眼瞼のほうが大きいので 25 、やはり上眼瞼のほうが分泌能力は大きく、眼瞼縁の脂質プールおよびその後の涙液油層に対する寄与も大きいと考えられる。しかし下眼瞼縁のほうが観察しや すいために、マイボーム腺の形態と分泌能力に関する研究のほとんどが下眼瞼を対象にしている。
下眼瞼への 注目 は特に、 Bron と Tiffany 43 および Chew ら 44,45 が導入した、眼瞼縁の有効脂質量を測定できるマイボメトリー 44 にも 適用されている 。研究によって、眼瞼縁のマイボーム腺脂質の量が示され、その 排出率 は年齢、性別、そして 1 日の時間帯によって変化することがわかった 45,49 。そうした研究においては、瞬目時に上眼瞼と下眼瞼の マイバム が混和するので、下眼瞼の脂質リザーバーは上眼瞼から得られる値と同じであろうと仮定されていた。辺縁部のリザーバーの量は、 14 歳未満の小児は成人よりも小さく、 成人 男性は 成人 女性より大きく、 50 歳以降は男女で差がなく、 80 歳までは一定 |
もしくは若干増加する場合もある 45,50 。辺縁部のリザーバーの脂質量が加齢とともに増大することは、活動性のマイボーム腺が加齢とともに減少していくという報告 50 とは対照的で、油層および脂質リザーバーからの脂質の除去が減少することでおそらく説明が可能だろう 43,50,51 。
マイボーム腺開口部に排出された脂質を染色して調べた Norm 52 の分析によれば、腺の分泌能力はある時点で開口している腺の 45 %しか活動的な排出が見られず、 20 歳から 80 歳までで活動性の腺は 50 %減少する 52 。こうした機能の低下に一致する形態学データとしては、マイボメトリーによって近年観察された腺組織の加齢性の消失(腺脱落) 53 が該当すると考えられる。腺の分泌能力については、 Korb と Blackie 51,54,55 がより詳細に分析している。彼らは、開口部が閉塞している場合は排出できない程度の生理的範囲内である 1.25 g/mm 2 という軽度の外圧をかけた診断圧出で液状分泌産物の排出能力を分析した。こうした研究により、同時期にすべての腺が脂質を排出しているのではないことが支 持された。さらに、下眼瞼の活動腺の数は、眼瞼縁上でのその腺の位置に依存しており、鼻側 3 分の 1 の部分がもっとも多く 51 、眼瞼の中央部ではそれより少なく、耳側 3 分の 1 のマイボーム腺ではさらに少ないことが、初めて示された。また、下眼瞼で排出を行なっている活動腺の数と、ドライアイ症状との間には相関があることも観察 された 51 。特定の弱い圧迫をかけて排出が止まるまでの腺の完全圧出時間は、平均しておよそ 12 秒であり、同じ腺から新しい脂質を再び圧出できるようになるまでにかかる時間はおよそ 2 時間である 54 。日中 9 時間に 3 時間の間隔を開けて(つまり 4 回)個々の腺を反復して圧出すると、個々の腺には日中の経過全体に渡って必要に応じて脂質を分泌できる能力があることが観察された 55 。マイボーム腺のこうした継続的活動は、すでに述べたように、瞼縁に沿った位置に同様に依存していることが示された。
マイボーム腺の 生理 機能と様々な種類の疾患における腺の変化をよりよく分析するためには、上眼瞼のマイボーム腺の分泌活動と能力に関する研究が必要である。
神経支配 身体の至るところにあり、主に ホルモン などの因子で制御されている皮膚の皮脂腺とは異なり、マイボーム腺は独立した神経支配を受けている。
ヒトのマイボーム腺には、腺房の周囲に無髄神経線維の密な網目構造(神経叢)があることが電子顕微鏡 32 および組織化学 56 で示されている。このネットワークを構成する神経線維には終末ボタンがあり、その中は神経伝達物質を含む小顆粒で満たされている。神経終末は腺房の周囲の すぐ近くに位置しているが、それでも基底膜よりは外であり、自律神経の特徴として、標的細胞に直接的な後シナプス構造がないいわゆるシナプス・アン・パサ ンを形成している。同様の神経線維は導管系の周囲にも見られ 56 、このことから最終的に供給される マイバム の構成成分に導管上皮が寄与していることが想定される。多数の神経線維が小血管の周囲や壁内にはあり 39 、腺房の周囲に密な網目構造を形成している 20 。
ヒトのマイボーム腺の神経線維は、主にアセチルコリンエス テラーゼ陽性であるので、コリン作動性副交感神経系の一部をなしていると考えられる 56 。また、ニューロペプチドであるカルシトニン遺伝子関連ペプチド( CGRP: calcitonin gene-related peptide )とサブスタンス P も含んでいる 57 。これらは、感覚神経系のマーカーだが、副交感神経系にも見られるものである。さらに、副交感神経系の血管作動性腸管ペプチド( VIP )も含んでいる 58 。こうした結果は、マイボーム腺が副交感神経系優位の神経支配を受けていることを物語っている
まとめると、マイボーム腺の神経支配はそれぞれ異なる神経伝達物質と異なる由来を持つ神経線維の密な 網目構造で維持されている。その神経としては、中心となる翼口蓋神経節由来の副交感神経の他に、上頸神経節由来の交感神経と三叉神経節由来の感覚神経があ る。翼口蓋神経節を経由する副交感神経線維は、涙腺にも神経支配を送っている上唾液核 に由来する ことがラットで示されている 59 。こうした神経支配パターンは、涙液層の最適な構成を達成するために、涙液層を構成するそれぞれの成分に関与する眼表面腺(油層担当のマイボーム腺、液層 担当の涙腺と副涙腺)が共有する制御方式 24 であるという可能性が浮かんでくる。前眼球涙液層のムチン層の主要成分である分泌型ムチンを分泌する杯細胞も同様の様式で制御されているものと考えられる 60 。マイボーム腺が、涙腺 と同様に 神経のフィードバック・ループ 61,62 にどのように実際に組み込まれているのかは、まだ分かっていない
神経終末で観察される神経伝達物質の放出、それぞれに対応する標的組織上での受容体、そして、それらの相互作用により伝達される作用様式に関する情報は現時点では少ない。
角化
上皮の角化の過程 マイボーム腺 の 胎生期の発生過程と構造の基本的特徴 は 睫毛の毛包と共通している。そうした共通特徴のひとつとして、上皮の全般的な角化がある。角化の初期段階ではケラトヒアリン顆粒が特徴的であり、その中に は、後に細胞質内に放出されてケラチン 中間径 フィラメント同士を相互に連結して密に詰まった網目構造を形成する役割を果たすフィラグリンといったタンパク質を含んでいる。角化しつつある表皮細胞すな わちケラチノサイトの細胞質はケラチン網目構造で徐々に占められていく 63 。架橋結合したケラチン束が細胞膜を強化し、周辺帯を形成する 64 。これらの細胞は核が変性・ 消失 した後、表層ケラチン層板を形成する。これが完全角質化(角化)の指標であり 63 、物理的・化学的ストレス因子から守る目的を果たしている。
初期の角化
ウサギとサルの正常マイボーム腺の導管上皮にはケラトヒアリン顆粒が表層側の細胞 層 にあることが電子顕微鏡で示されている 32 。ヒトの正常マイボーム腺には明白な角化は見られないが、最近の組織学的研究( Knop E, et al. IOVS 2009;50:ARVO E-Abstract 4833 )により、ヒトのマイボーム腺の中央導管と小導管の上皮全体にもケラトヒアリン顆粒が含まれており、角化の準備をしていることが確認できるようになった。 したがって、マイボーム腺は基本的に「毛幹のない毛包」と見なすことができる 30 。 |
From the 1 Ocular Surface Center Berlin, Department for Cell and Neurobiology, Center for Anatomy, Charité–Universitätsmedizin Berlin, Berlin, Germany; the 2 School of Science, Food, and Horticulture, University of Sydney, Penrith South DC, New South Wales, Australia; the 3 Department of Ophthalmology, Jichi Medical University, Tochigi, Japan; and the 4 Schepens Eye Research Institute and 5 Department of Ophthalmology, Harvard Medical School, Boston, Massachusetts.
Supported by the Tear Film and Ocular Surface Society (TFOS; http://www.tearfilm.org); individual author support is listed in the Appendix of the Introduction.
Submitted for publication December 6, 2010; accepted March 23, 2011.
Disclosure: Each Workshop Participant's disclosure data can be found in the Appendix of the Introduction.
Corresponding author: Kelly K. Nichols, College of Optometry , 338 W. 10th Avenue , Ohio State University , Columbus , OH 43210-1280 ;
knichols@optometry.osu.edu. |
|
|
| |
|
 |
|