| |
|
| Report of the Diagnosis Subcommittee |
Alan Tomlinson 1 Anthony J. Bron, 2 Donald R. Korb, 3 Shiro Amano, 4 Jerry R. Paugh, 5 E. Ian Pearce, 1 Richard Yee, 6 Norihiko Yokoi, 7 Reiko Arita, 8 and Murat Dogru 9
|
マイボーム腺機能不全( MGD )および MGD 関連疾患の診断検査は、腺の解剖学的組織および生理機能の異常を実証することと、特定の病理変化を検出することに基づくものである。このため、本分科委員 会レポートは 2 つのセクションから成る。パート I では、現在実施可能な検査に関係するマイボーム腺の解剖学的組織と生理機能の側面について説明する。解剖学的組織と生理機能に関するさらに全般的な説明 は、本ワークショップの解剖学分科委員会のレポートで報告する。パート II では、各検査およびその成績について詳細に説明する。パート III では、主な検査の実用的応用例の概要を示し、将来的なアプローチについて推奨を示す。補足的推奨事項と、関連する文献および考え方の要旨は付録 1 ~ 17 に示す。
I .マイボーム腺の解剖学的組織および
生理機能:臨床的意義
マイボーム腺は瞼板表層に位置するため、マイボグラフィーおよび共焦点顕微鏡によってその解剖学的特徴を定量化することが可能である (付録: 7, 8 )。正常者では、マイボーム腺開口部が眼瞼縁に沿って一定間隔で位置しており、粘膜皮膚移行部( MCJ )のちょうど前部にある。生体顕微鏡検査によれば、マイボーム腺は特徴的なリング状構造に囲まれており、開口部、粘膜、遠位腺房、リオラン筋繊維および腺 の結合組織鞘が同心状に配列している( Fig.1 ) 1, 2 。高齢になるとこの境界が不明瞭になり、進行性 MGD では消失する 3 。この構造の消失はスコア化でき、 MGD の重要な臨床的所見である。
マイボーム腺の油性分泌物は眼瞼の温度では液状であり、眼瞼縁の皮膚まで、マイバム( meibum )と呼ばれる透明な液体として分泌される 4 。ここで、上下の眼瞼縁上で貯留槽(リザーバー)を形成し、この眼瞼縁から涙液油層( TFLL: tear film lipid layer )が形成され、補充される。正常な下眼瞼のリザーバー中に存在する脂質量はマイボメトリー 5-7 を用いて測定することができ、眼瞼リザーバーの全容量を推測するために用いることができる。マイボメトリーでは、マイバムのサンプルを下眼瞼中央部 1/3 のところから、プラスチックテープのループの上に直線状に吸着させ、一定範囲に存在する脂質の量を、光学密度の変化によって測定する(付録 9 )。健常成人では、上下のリザーバーに含まれる全脂質量は、約 300 μg と推測されている 5, 8 。この計算は、マイボーム腺のリザーバーが上下の眼瞼で同じように割り当てられていると仮定し、標準脂質に対する比較に基づくものであった。しかし、上下 眼瞼縁上の基礎レベルの比較はまだ行なわれていない。この技術は、マイボーム腺の破壊を定量化するために用いることが可能であるが 9 、 MGD の場合、この読み取り値から両眼瞼全体における破壊の程度を外挿して推定することはできない。これは眼瞼長によって疾患が異なるためである。
涙液層の脂質に関する報告書で詳細を述べたように、マイボーム腺分泌物はコレステロール、ワックス、コレステリルエステル、リン脂質が、少量のトリグリセリド、トリアシルグリセロールおよび炭化水素と複雑に混ざったものである 4, 10-43 。
リン脂質の成分は、涙液層が広がるために必要な、 TFLL と涙液層におけるその下の水層との間で相互作用する基盤として考えられてきた 17, 44 。しかし、最近の研究では、マイボーム腺脂中のリン脂質が極微量であることが報告されており、この相互作用に関して他の候補を探す必要がある可能性がある 20, 22, 24 。これは現在も議論されている。炭化水素と、量は比較的少ないもののトリグリセリドの存在は、部分的には皮脂と環境中の化学物質の汚染によるものとして解 釈されている。
脂質混合物の溶融温度幅は、 19.5 ℃~ 40 ℃の範囲であることにより、眼瞼表面の脂質混合物の流動性が確保される 45 。脂質混合物の溶融温度幅はさらに TFLL 中のその安定性にも影響する。これは、角膜の温度が、眼瞼縁の温度よりも低いためである(約 33.5 ℃) 46 。この温度差が、一連の連続的瞬目の間、 TFLL の持続的完全性(ヒダ付カーテン効果、後述)という TFLL 動力学の通常の特徴の基準となっている可能性もある 47 。 TFLL の安定性は静的および動的干渉法を用いて測定できる可能性がある(付録 10 参照)。
マイバムの分泌および輸送の様式は、有機溶媒を用いて上下の眼瞼縁から脂質を完全に取り除いた後に下眼瞼リザーバー上の脂質の回収物を追跡するマイボメト リーを用いて検討されている 5 。全身麻酔下で手術を受けた健常成人の場合、 3 分から 40 分の間に部分的な回復が生じ、これは分泌と輸送が瞬目なしでも継続することを示している。さまざまな研究で、一定割合のマイバムが、一部の腺から TFLL に直接排出される場合があることが示されており 6, 27, 48 、これに基づいて、 瞬目がマイボーム腺脂を TFLL に広げる役割を果たしていると一般的に考えられている。 |

FIGURE 1. Normal lid margin, showing meibomian orifices ( arrows ) and clear, expressed oil (courtesy of A. Bron).
|
最近の研究では、一つのマイボーム腺から圧出した後の分泌物の回復を追跡している 49, 50 。この研究では、標準化した装置を用いて、下眼瞼中央に位置する個々の腺に一定の力をかけ、腺からマイボーム腺脂を排出させた。 18 歳~ 25 歳の被験者 12 例による試験で選択された腺は、圧力をかけて 2 秒以内に分泌し始めるという点で、最適な分泌状態であった。排出を生じる平均時間は 12.1 ± 3.5 秒(範囲: 8 ~ 20 )であり、分泌が部分的に回復するまでの時間は 2.2 ± 0.5 時間であった。部分的な回復後に圧出を繰り返して、分泌液を管内から一掃するのにかかった時間は、最初に排液するのにかかった時間の半分であった 49, 50 。
Chew 5 はマイボメトリーを用いて、下眼瞼リザーバー中のマイボーム腺脂の基礎レベルは、起床後 1 時間以内が最も高いことを見いだした。この知見は、睡眠中など瞬目をしない状態で長時間閉瞼する際には分泌された脂質が管内で貯留したままになること、お よび開瞼時には蓄積した脂質が放出されることを反映していると解釈された。しかし後者の仮説では、脂質分泌の変化が影響している可能性が無視されていた。 脂質分泌の変化は、眼瞼縁から眼瞼皮膚をつたわって生じると考えられている。さらに、長時間閉瞼することでマイボーム腺脂の排出量が減少することにより、 起床直後に記録される基礎レベルは上昇するであろうということに留意すべきである。この疑問は、圧迫と排出の方法を用いた試験によって解決できるはずであ る 49, 50 。
マイボーム腺の活動性( activity )
数名の著者が覚醒状態のマイボーム腺の活動性( activity )に関する問題に取り組んでいる。活動性という用語はマイボーム腺脂の圧出性を意味する。 Norn 51 は、 Sudan black を用いた染色、または下眼瞼の全体に沿って指による圧力をあてることで、成人の腺の約 45% が所定の時間、活動性にあると結論づけた。ここで、自然な状態では、活発に分泌している腺から脂質を受けとる導管は液状の脂質で充満しており、これは包含 する油を圧出する能力に反映されるであろうということが想定された。
このような知見は、標準化したマイボーム腺圧出法を用いた最近の研究によって裏付けられている。 Korb と Blackie は、マイボーム腺圧出の標準的技術を開発している。これは 1.25 g/mm 2 の一定の力を眼瞼の約 40 mm 2 の領域にかける特別仕様
の圧出装置(付録 6 )を用いたものである( Fig.2 )。この力は、自発的な瞬目中に眼瞼によって眼球にかかる力と、故意に強制的に眼瞼を閉じる際にかかる力の中間に近い力とした。 Miller 54 が引用している Comberg と Stoewer の研究では 53 、眼瞼を強く圧迫した結果、眼圧は 18 mmHg ~ 70 mmHg の範囲で上昇し、一方、 Korb の圧出装置では、眼圧は 30 mmHg ~ 40 mmHg の範囲で上昇している 49, 50, 52 。
この装置は、約 8 腺から同時に圧出することができる(眼瞼の長さの約 1/3 を占める。すなわち 8 腺 /24 腺)。腺の圧出性は、 8 腺のうち液体の分泌物が性状の質に関係なく圧出された数によってスコア化される。これがマイボーム腺産生液状分泌物( MGYLS: meibomian glands yeilding liquid secretion )スコアである。正常な若年被験者の少人数のグループで、下眼瞼全体の平均 MGYLS スコアは 10.6 ± 2.6 であった。範囲は 6 ~ 15.5 であり(下眼瞼に 24 腺あると仮定すると、 25% ~ 65% が活性あり)、個体間の活動性には顕著な差が存在することが示唆された。また、このような研究から、鼻側がわの腺が最も活性化し、続いて中央部の腺、耳側 がわの腺の順に活性であることが一貫して示されている。正常なサンプルでは、耳側がわの腺の 86% と鼻側がわの腺の 6% で MGYLS スコアが 0 であることが分かっている。これらの結果から推測できることは、簡単な方法を用いた Norn によってすでに提唱されているが、一部の腺のみが常に活発に分泌しているということである。また、鼻側がわの腺は、耳側がわの腺よりもかなり活性化してい るように思われる。 Pflugfelder ら 55 もまた、上眼瞼のマイボーム腺圧出を評価を行い、全ての腺が連続的に圧出はしておらず、圧出性の低下が疾患の指標であると仮定した場合、 5 腺の圧出性を評価するという基準を示した。
Blackie と Korb 56 はさらに、ドライアイの自覚症状や他覚所見のない若年健常者で個々のマイボーム腺の分泌活性を検討したことを最近報告している。午前 8 時にマイボーム腺から液体の分泌物が排出された場合、下眼瞼に沿った場所によっては、 1 日 9 時間を通して液状の分泌物が排出され続ける可能性が高いことがわかった。例えば鼻側がわの腺の 70% 、中央の腺の 30% 、耳側がわの腺の 20% が 1 日 9 時間を通して液状の分泌物を排出する。午前 8 時にマイボーム腺から液状の分泌物が排出されない場合、液状の分泌物は 1 日の中で散発的に排出されるのみか全く排出されない。上眼瞼のマイボーム腺が同様に機能すると仮定した場合、辺縁部の脂質リザーバーは、腺全数の一部の活 動性のみで維持されるようである。さらに、一時的に不活性である個々の腺が数日または数週間後に活性化するかどうかについては、今後の関心事項である。マ イボーム腺活性に |
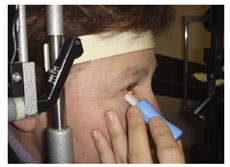
FIGURE 2. Standardized meibomian gland expression performed at the slit lamp using a diagnostic expression instrument (Korb and Blackie 52 ). See text for further details (courtesy of D. Korb). Reprinted with permission from Korb DR, Blackie CA. Meibomian gland diagnostic expressibility: correlation with dry eye symptoms and gland location. Cornea. 2008;27(10):1142–1147.
|
におけるこのような日内変動を検証することで、将来的には MGD の診断に用いることができるようになる。
以上の見解は、他のグループによってまだ確認されていないものの、一連の腺の圧出性を測定することに基づいたマイボーム腺機能に関する 検査にとって重要な意義を持つ可能性がある 55 。圧出可能な腺のみの割合に基づくと(圧出された分泌液の質、開口部の状態、および局所的な腺脱落の有無に関係なしに)、生理的理由または病理的理由に よって(すなわち MGD の存在によって)圧出されない腺を区別することは困難である。開口部疾患の細隙灯下観察が有用なこともある。また、試験者が疾患の評価法として圧出性を選 択する場合、整合性を保つために評価する部位を特定したほうが適切な可能性がある(例えば、眼瞼の鼻側 3 番目)。
このような研究から、マイボーム腺分泌の時間的特性について重要な疑問も生じており、眼瞼を横切るように徐々に腺から腺へと活動性のサ イクルにおいてマイボーム腺は連動している可能性もある。このような考えから、各腺には、分泌液が放出される活動期と、それに続き、代わりに他の腺がその 役割を果たす休止期があることが示唆されている。この仮説は、マイボーム腺脂の分泌に関する全分泌モードと一致する。これは短期間(例えば 24 時間のような)では起きないが、長時間かけてゆっくりとしたサイクルで起きている可能性があり、臨床試験の実施に関係する可能性があることが、既に引用し た研究から示唆される。
涙液油層
正常な TFLL の厚みの範囲は約 20 ~ 160 nm と報告されており 57, 58 、涙液層の最前部を占めており、眼の露出面から蒸発による水の消失を低減する上で重要な役割を果たしている。この層は干渉計で観察可能であり、主要なスペ クトル色が TFLL の厚みを表している( Fig.3 、付録 10 )。干渉計(あるいは、層中の粒子の運動を記録すること)によって、油層は、瞬目の上向きの動きでは上方向に広がり、約 1 ~ 2 秒後には比較的安定になることが観察できる 59 。 Owens と Phillips 60, 61 は 1.05 ± 0.39 秒という数値を報告しており、一方で Goto と Tseng 62 は、異なる方法を用いて、健常眼では 0.36 ± 0.22 秒、涙液油層が減少した眼では 3.54 ± 1.86 秒という数値を報告している。 King-Smith ら 59 は油層が全体で 3.23 mm を上向きに 0.564 秒で動く流れに関する指数関数的減衰と関連した時間定数を示している。油層が広がる時間が長くなることは、涙液水層が減少している指標となるかもしれない が、今のところ一般的
な臨床に用いられる正式な試験には転用されていない( Yokoi N, et al. IOVS 2010;51:ARVO E-Abstract 5201 )。瞬目に要する時間は正常な場合、約 200 ms ~ 300 ms である 63, 64 。水平方向の波面の運動方向からは、 TFLL は主に下眼瞼リザーバーから涙液層に輸送されていることが示唆される。マイボーム腺脂が涙液層の下層の水層に広がることが可能な説明として、 TFLL は、涙液層の水相の上に広がる内層の極性を有するリン脂質層を持つラメラ構造であることが提唱されている 17, 44, 65 。既述のように、マイバムのリン脂質含量が少ないことが最近の報告 20 では示唆されており、別の油層構造を検討する必要がある可能性がある。さらに表面の油層は、コレステロール、ステロール、ワックスエステル等の、極性相の 上を伸展する非極性脂質から構成されていると仮定される。 TFLL の伸展を干渉計で観察する場合、可視化されるのは TFLL の全厚みである点は強調しておく必要がある。極性油層は非極性層の前部に存在すると仮定されているが、薄すぎて干渉パターンを作れない可能性がある。 TFLL の菲薄化は、涙液油層減少で報告されている 66 。
正常者では、 TFLL の干渉パターンは複数の瞬目サイクルの間、見かけ上は比較的一定であり、このことから、その構造が瞬目と瞬目の間である程度保持されていることが示唆され る。下方向に動く完全な瞬目の最後には、眼瞼縁が並置し、脂質リザーバーが結合すると予想されるにもかかわらず、構造はこのように保持されている。この現 象の説明として、安定期には TFLL が瞬目の下向きの動きの際に、折りたたみ構造のように折り重なり、上向きの動きの際に広がって元通りになることが提唱されている 57 。しかし、干渉パターンの微妙な、またはいっそう顕著な変化が瞬目の間に観察される点は注意すべきである。これは層内における脂質の局所的移行または油層 の並置する折りたたみ構造を通した交換により、層内のある種の分子的再構築を暗示している。複数回の瞬目後のある点で、干渉パターンには急速かつ完全な変 化が生じており、これはマイボーム腺リザーバーが結合することで TFLL が混ざることを示唆している。その結果、 TFLL が完全に再構築され、このサイクルが再び始まる。この安定化パターンは、脂質混合物の流動性に影響を及ぼす開瞼時の眼球表面温度、および溶融範囲に影響を 及ぼすマイボーム腺脂の組成によって影響を受けやすい。安定化サイクルは MGD では短くなり、これは、動力学的油層干渉パターン( DLIP: Dynamic Lipid Layer Interference Pattern )検査において、 MGD 関連疾患の検査方法として提唱されている 67 。
このような背景の下、マイボーム腺の生理機能は以下のように要約できる。マイボーム腺は神経およびホルモンによる制御を受け、眼瞼縁の貯留 槽(リザーバー)中に脂質を分泌する。この分泌は腺にもともと備わっているものであり、瞬目がその輸送を助ける。常に活性化しているのは腺のごく一部だけ である。各腺は活性サイクルを経た後、腺房の貯蔵分を補充する休止期を迎えるものと推察されている。眼瞼全体で活性化している腺の分布は不均一であり、耳 側がわが最も少なく、鼻側がわが最も多い。睡眠中は、分泌された脂質が腺に蓄積し、過剰分は覚醒時に瞬目に伴い排出されると仮定されている。マイボーム腺 からの直接圧出 68 と同じく、辺縁部の脂質リザーバーも TFLL の供給源である。瞬目の上向きの動きの際は、下眼瞼のリザーバーから涙液層に脂質が広がり、極性脂質または TFLL の他の界面活性成分と共に TFLL を形成し、涙液層の水相と相互作用を生じる。 TFLL は一旦形成されると、両リザーバーからの脂質と涙液油層の脂質が混ざって急激に再構築されてサイクルが再開するまでは、瞬目間で比較的安定に維持される。 |
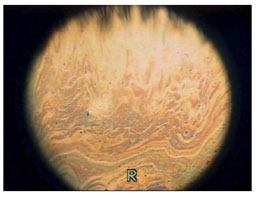
FIGURE 3. Spreading of a normal tear film lipid layer image by interferometry (courtesy of N. Yokoi ).
|
この説明の詳細については、多くの点がまだ分かっていないが、上記の要約は診断方法を選択し解釈 する上で有用な可能性がある。 MGD がそれ自体で発生しているのか、あるいはさまざまな疾患の一部であるのかにかかわらず、診断においてその症状を他の関係のない眼表面疾患と区別する必要が ある。
眼表面疾患
結膜、角膜、眼瞼に影響するいくつかの症候性疾患は、便宜上、眼表面疾患( OSD: ocular surface disorder )というカテゴリーにまとめることが可能である 69 。これには、眼瞼、結膜の疾患と、涙液減少型および蒸発亢進型ドライアイの原因となる疾患が含まれる。ある程度はオーバーラップしており、これは、 1 つのカテゴリーの疾患が他のカテゴリーの疾患と関連する可能性があるためで、 MGD がそのよい例である。これは MGD 自体が疾患として存在して眼表面の障害を引き起こすこともあれば、蒸発亢進型ドライアイの原因となることもあるためである。このような疾患は、 Berens らが涙液機能不全症候群( DTS: dysfunctional tear syndrome )と呼んでいるものに相当する 70 。その報告の中で、 DTS という用語は、ドライアイという用語を置き換えるものとして示されており、 DTS はドライアイを含む症候性眼表面疾患のあらゆる原因を説明するものと合理的に考えることができる。
特定の疾患をこの大きな群の他の疾患と区別しようとすれば、特定の疾患と正常な状態を区別するだけでなく、その疾患状態と OSD のさらに大きい群の他の疾患とが診断によって差別化できなければならない。本報告では、 MGD に焦点を当て、涙腺機能に関する選択された検査方法を解説する。これは、ドライアイの診断に関係して、蒸発亢進型ドライアイの診断のための精密検査の一部 として正常な涙腺機能が示されなければならないためである。検査グループが検討したマイボーム腺および涙腺機能の検査および蒸発による水の消失に関する検 査のリストを付録 3 および付録 5 ~ 14 に記載している。
マイボーム腺機能不全
本報告は全体として主に MGD を取り扱う。マイボーム腺の他の疾患は Table 1 にまとめており、定義および分類に関する報告の中でも議論されている。 MGD という用語は、後部眼瞼炎と同義語のように文献中で広く用いられており、前部眼瞼炎という用語と対照的に用いられてきた 1, 36, 71-74 。しかし、定義および分類に関する分科委員会で議論されているように、 MGD は後部眼瞼炎の複数の原因の一つにすぎない。したがって、明確にするために、 MGD という用語だけをここで用いる。
MGD は、腺圧出またはマイボグラフィーのみで検出可能な無症候性で無症状の状態である。あるいは、症候性で特定の臨床所見を伴うことがある( Table 2 )。 MGD は原発性で、他の局所性または全身性疾患を伴わないこともあり、または全身性疾患、特にいくつかの一般的な皮膚疾患、例えば酒さ性痊瘡、アトピー性皮膚 炎、乾性脂漏症、さらに瘢痕性結膜疾患(トラコーマ、スティーブンス・ジョンソン症候群および眼類天疱瘡)から続発することがある 1, 75 。また、薬物および毒物への曝露が原因となって臨床的に発生することもある。 MGD には複数の実験モデルが存在する 76 。
MGD は、散在する腺を冒す場合は限局性であり、全ての腺をある程度冒す場合はびまん性である可能性がある。 MGD の自然経過についてはこれまで検討されていないため、限局性疾患が常にびまん性疾患の前兆であるかはわかっていない。
瘢痕性または非瘢痕性(単純)および炎症性(マイボーム腺炎)または非炎症性であることもある。 MGD の特徴的な所見としては、腺の圧出時、または圧出による分泌なしで、混濁したマイバムまたはさらに粘性の高い物質の放出がある。また、マイボーム腺開口部 が、無傷の皮膚( meibomiana )か、または酸化脂質および上皮性物質ではないかという仮説がある蓋に覆われた脂質小球によって覆われる場合がある。
MGD は単一の罹患した腺を示すことで診断することがあるが、臨床的に重要な疾患は複数の腺が関与するものである。このため、診断には、定性的および定量的な方法が必要となる。
MGD はそれ自体が症候性であるか、眼表面の障害またはドライアイに関与することを通して症状を引き起こす。原発性 MGD のメカニズムは分かっていないが、非瘢痕性 MGD の病理変化には、導管の角質化亢進、導管内腔の細胞性および脂質性物質の蓄積、導管、腺房の嚢胞性肥大およびマイボーム腺腺房の二次的な非活動性萎縮 73, 77-79 等の導管障害、そして少なくともいくつかの例では腺周囲の炎症性変異 202 が含まれる。
MGD の臨床所見は、マイボーム腺単独または直近の眼瞼組織を含む場合は内因性であり、または近傍の腺構造を冒している場合は外因性である可能性がある。内因性 の特徴としては、開口部の閉塞、導管障害および肥大、腺の萎縮と脱落および圧出された分泌物の質的変化がある。外因性の特徴としては、 MGD の存在が原因となった二次的変化があるが、これ これは他の OSD でもみられる。また、眼瞼縁充血および末梢血管拡張が含まれる。 |

TABLE 1. Classification of Diseases of the Meibomian Gland
|

TABLE 2. Grading of MGD According to Clinical Features and Gland Expression
|
II. MGD の診断および定量化
A. MGD の臨床的サブタイプおよび関連
臨床的には、 MGD は 4 つのサブタイプに分類可能である。詳細を以下に示す。
1. MGD 単独
無症候性
症候性(非瘢痕性、瘢痕性)
2. 眼表面障害と関連した MGD
3. MGD 関連蒸発亢進型ドライアイ
4. 他の眼疾患と関連する MGD
このようなサブタイプの特徴を明確にするには、まず MGD 自体の診断と定量化が必要であり、その後、他の OSD を含めるかまたは除外することになる。診断法は、後の説明の中で簡潔に言及する。各検査法の詳細は付録で説明する。
MGD 単独 無症候性 MGD (発症前) MGD は症候性疾患であるが、他の疾患のように、無症候性の発症前段階を経る。これはその存在が臨床的な検査者にはわからない段階である 49, 50, 80-82 。この段階では、マイボーム腺圧出によって診断され、圧出される分泌物の質的変化および/または圧出の低下または欠如が示される。進行と共に、 MGD は症候性となる可能性が高く、眼瞼縁のさらなる所見(例、充血)が細隙灯を用いて検出される可能性がある。この時点で MGD 関連「後部眼瞼炎」が存在していると言えるかもしれない。
Korb と Henriquez 80 はマイボーム腺の圧出性をコンタクトレンズ不耐性がある患者とない患者で、マイボーム腺を弱く圧出した場合と強く圧出した場合について検討した。無症候性 群で、弱い圧出では概して透明な脂質が放出され、濃縮された練り歯磨き状の粘着性物質が出ることはほとんどないことを確認した。また、無症候性群では、圧 出可能な腺の頻度は高かった。強い圧出では、圧出可能な腺の数は増加し、さらに、より多くの分泌物が個々の腺から圧出された。複数の無症候性の被験者で、 簡単な臨床検査で眼瞼が明らかに正常な場合でも、圧出により、クリーム状または濃縮された物質が複数の腺から出ることがあり、これは MGD の存在を示す重要な所見である。無症候性
MGD の存在は Hykin ら 83 によって報告されており、 Hykin らは加齢と共に MGD の臨床所見が増加するが、眼瞼関連の症状がないことを初めて報告した。さらに、 Mathers ら 43 は、病歴的に正常な被験者におけるマイボーム腺の脱落について記録した。 MGD 発症前の段階で、見かけ上年齢相応の正常な眼瞼縁を呈する場合、臨床で診断するには圧出またはマイボグラフィーが必要となる可能性がある。
発症前のどの特徴により進行する疾患を予測できるかを明確にすることが重要である。これは、早期の治療が疾患の進行を遅らせるか、または病 理変化を逆行させるかどうかという問題が生じるためである。疾患の早期治療は比較的単純であり、疾患早期の発症前の段階で治療を行なう十分な理由がある可 能性があることから、無症候性 MGD の存在を検知するためにマイボーム腺圧出を実施する必要性が示唆される。
症候性 MGD MGD には自覚症状および他覚所見がある。自覚症状は本疾患の顕著な特徴である。
MGD の症状 1995 年の世界ドライアイワークショップでは、自覚症状がドライアイの全般的な特徴のリストに含まれ、それぞれの自覚症状はドライアイの不可欠な要素となってい たが、その関連性を涙液減少型または蒸発亢進型ドライアイに結びつけていなかった 84 。全般的な特徴には、自覚症状、眼表面障害、涙液不安定化、涙液の高浸透圧化が含まれる。同様のことは、 2007 年の DEWS レポートで繰り返されている 85 。涙液減少型ドライアイを蒸発亢進型ドライアイと区別できる症状を特定する試みはされていない。
MGD は一般的な疾患であり 1, 47, 57, 86-89 、蒸発亢進型ドライアイと関連している。さらに、強いエビデンスではないが、蒸発亢進型ドライアイはドライアイ疾患として最も広く発生する形態であること も示唆されている( Castillanos E, et al. IOVS 2008;49:ARVO E-abstract 2371 )。 MGD はそれ自体が症候性の疾患であり、眼瞼疾患から生じる症状と関連する眼表面疾患の結果として発生する状態がある。 MGD が蒸発亢進型ドライアイの原因として発症している場合、関連する疾患がドライアイ自体の症状と区別がつくかについて疑問を持つ必要がある。しかし、現在の ドライアイ症状に関する質問票は、 MGD の症状をドライアイの症状と区別するようにデザインされておらず(例、別の領域にある)、涙液減少型と蒸発亢進型ドライアイを区別するようにもデザインさ れていない(付録 1 )。この不備は改善されるべきであり、 MGD の特徴を捉え、涙液減少型ドライアイと区別できる質問を明らかにすることは可能と考えられる。
MGD は眼瞼の症候性疾患であり、 MGD から生じる蒸発亢進型ドライアイと明確に区別される一方、両者の間の診断上の分岐点はまだ検討されていない。それにもかかわらず、眼表面疾患の特徴がない 正常者と MGD の症状のある患者で蒸発速度を比較した研究報告 89-92 の中で、蒸発速度が正常な範囲まで低下した MGD 患者(すなわち、蒸発亢進型ドライアイのカットオフ値以下)は、症候性 MGD 単独または MGD 関連眼表面疾患の患者であると推定できる可能性があった。蒸発亢進型ドライアイと涙液減少型ドライアイの phenotype によって細分されるグループで、蒸発(および涙液のターンオーバー速度)が考慮された最近のドライアイ疾患のメタアナリシスから得られたエビデンスに基づ き、両者にとって全体的に入り混じった病因が示唆されている 93 。 MGD に特異的な症状を特定するためには、「純粋な」 MGD phenotype の個体は、さらに検討する上で興味深いグループに相当する。眼瞼に関連
する症状のもう一つの原因である前部眼瞼炎と MGD を区別することは特に興味深い。現在では、 MGD 自体に特異的な症状を特定するための一貫した取り組みは行なわれていない。
現在利用可能な自覚症状の質問票を使用する上で生じる一つの問題は、質問票をドライアイの診断で唯一の確認方法として用いた場合、ドライア イのない純粋な MGD が見かけ上ドライアイと判断され、検査の特異性を低下させるかどうかである。ドライアイ疑い例では、 MGD 、眼不快感の症状、眼表面の染色がみられ、涙液油層の指標は変化するが、涙液の浸透圧の上昇はみられない可能性がある。一つの期待は、少数の選ばれた質問 からなる MGD の領域を既存の質問票に追加することであり、これによって、自覚症状に関与するものとして MGD (または少なくとも「眼瞼炎」)が診断可能になるであろう。対立仮説は、検査データのみに基づいて MGD を他の眼疾患と区別することはできないということであり、この場合、本疾患を完全に区別するためには、自覚的および客観的な方法を組み合わせなくてはなら ない可能性がある。
MGD を特徴づけると予想される複数の症候性の特徴には、病態に関係する個人の習慣、例えばそう痒感や刺激感を軽減するために眼瞼をこすること、形態的特徴、例 えば、痂皮または薄片はみられないが、目に見える眼瞼縁の変化(発赤、腫れ)、および、眼瞼縁に帰するといえる感覚性の症状(そう痒感、刺激感、痛み)が 挙げられる。
MGD の臨床所見 MGD の重要な所見はマイボーム腺の脱落、マイボーム腺分泌物の変化、眼瞼の形態変化である。それぞれの項目について既存の分類方式を含め、順に説明する。
マイボーム腺脱落 マイボーム腺脱落とは、マイボグラフィーで検出される腺房細胞の欠落のことである( Fig 4, 5 )。これは、部分的または全体的な腺房細胞の欠落を意味している。初期の診断技術では、眼瞼を翻転し、透過法を用いてマイボーム腺の輪郭を観察する。光源 を眼瞼の皮膚側に当て、裏返した粘膜側から腺の配置を観察して、記録する。腺の詳細な構造は、若い人ほどよく見ることができるが、年齢と共に境界が不明確 になる。この診断方法の適用範囲は、眼瞼を翻転して赤外線写真で腺を記録する非侵襲性マイボグラフィーの導入によって拡大してきた 79 ( Fig 4 付録 7, 8 )。 |
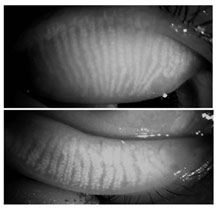
FIGURE 4. Normal meibomian glands of a 38-year-old woman, viewed by infrared meibography shows scattered gland absence or irregularity (courtesy of R. Arita).
|
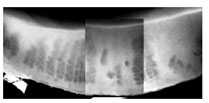
FIGURE 5. Photographic montage of the lower lid viewed by transillumination meibography. There is extensive meibomian gland dropout in a patient with meibomian gland dysfunction (courtesy of N. Yokoi ).
|
マイボーム腺脱落は、正常者では年齢と共に増加するが 43 、これは必ずしも閉塞性 MGD の存在によるものではない。 Obata は、腺の脱落も年齢に関係する萎縮性過程として発生することを示唆している 78 。 MGD の特徴はその脱落が測定可能なことであり、消失は MGD の重症度に応じて増加するという仮説が持たれている。消失は近位(眼瞼の付着縁)、中央部、遠位(眼瞼の自由縁)で起きるか、または、腺全体を含むことが ある。広範な脱落は眼からの蒸発による水分消失が増加することと関連している 86, 87, 90 。マイボーム腺の大部分の全損、冒された腺の数、脱落箇所(例、近位対遠位)のいずれか、またはその組み合わせが他のマイボーム腺指標に最も影響を与えて いるかを特定することが将来的には重要になる。この指標には、眼瞼の臨床所見、縁部脂質リザーバーの大きさ、油層の伸展と完全性、脂質組成および蒸発速度 を含む。脱落箇所と、閉塞の存在、圧出性または圧出された脂質の質の間の相関を調べる研究は行なわれていない。遠位すなわち開口部に近い位置での脱落は、 機能的に最も深刻な影響を与え、 MGD の診断に最も密接に相関する可能性があると予想されている。部分的な脱落のある腺では脂質組成が変化するかどうかも明確ではない。
マイボーム腺分泌の変化: 若年正常者で、指で圧力を瞼板に加え、導管内と、場合によっては近位腺房に透明な油の貯 蔵として存在するマイボーム腺分泌物を押し出す。この分泌物もマイバムとされる 4 。 MGD では、圧出された物質の質と圧出性が共に変化する。この物質は、変化した分泌物と角質化した上皮細片残屑の混合物からなり 95 、マイボーム腺排泄物( meibomian excreta) とも言われる。圧出性と分泌活性は同じではないことは認識しておく必要がある。マイボーム腺の脂質が自由に圧出される部位では分泌が「正常」であると単に 考えられているだけである。
MGD では、圧出された脂質の質が外観上、透明な液体から濁った液体、そして粒子状物質を含む粘性のある液体と緻密で不透明で濃縮された練り歯磨き状の物質に変 わる( Fig. 6 ~ 8 )。このような特質は種々の分類方法に組み込まれている 75, 96, 97 。または、指による圧力で圧出される腺の圧出性が分類されており 55, 87, 98 、一定の力のかかっている間の単一または複数の腺からの圧出性が Korb と Blackie によっても測定されている 49, 50, 52 (付録 6 )。 |
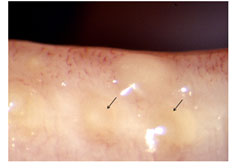
FIGURE 6. Meibomian gland dysfunction. Cloudy expressed meibum ( arrows ) (courtesy of A. Bron). |
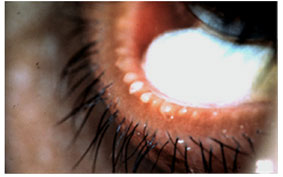
FIGURE 7. Meibomian gland dysfunction: expression of opaque meibum (courtesy of D. Korb).
|
眼瞼形態上の変化 複数の形態的な特徴がさらにあり得、分類方法の中に組み込まれている。この特徴は以下および付録 5 で要約されている。
マイボーム腺開口部のプラグ形成 マイボーム腺開口部は眼瞼の表面レベルより上に盛り上がることがあり、プラグ形成( plugging )または突出( pouting )と呼称される。これらは導管の障害およびマイボーム腺脂質と角質化細胞残屑の混合物(マイボーム腺排泄物、 Fig. 9 )の押し出しによるものである。これは MGD の疾病に特徴的な臨床上の所見である。
マイボーム腺開口部および粘膜皮膚移行部 MCJ と関係するマイボーム腺開口部および MCJ 自体の前後の位置に影響する、さらに重大な変化が生じる。この移行部は、眼瞼縁の脂質で湿った皮膚と可湿性の粘膜の間の分岐点を形成するため重要である。
非瘢痕性 MGD は、以前は「単純性 MGD 」 1, 75 と呼称されており、初期は開口部が MCJ の前部に位置し続ける。この状態では、マイバムの輸送を修復することで、脂質が再び TFLL に移ることができる。
かし、 Yamaguchi ら 99 が Marx's line の研究の中で観察したように、 MCJ は年齢と共に前方に移動し、粘膜中で、開口部が移行部の後方に位置する原因となる。この過程は結膜化と呼ばれてきた 36 。 Marx's line は MCJ のすぐ後方で染色される結膜上皮であり、ローズベンガルとリサミングリーンなど |
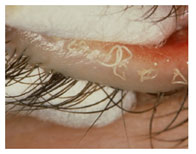
FIGURE 8. Meibomian gland dysfunction: strings of toothpaste-like opaque meibum expressed in response to forceful bimanual gland expression (courtesy of D. Korb). |
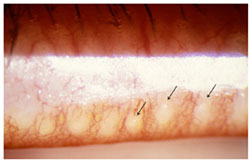
FIGURE 9. Cicatricial meibomian gland dysfunction. Lid margin hyperemia with orifice opacity with plugging ( arrows ); (courtesy of A. Bron).
|
などの色素で示すことができる 100-103 。男女問わず全ての年代で、全ての正常な眼瞼に存在する。 Yamaguchi ら 99 は年齢と共にこのラインが前方に移動し、孤立したマイボーム腺開口部を最初に浸食し、同じレベルで横に並び、最終的に腺開口部に対して前方に移動すること を示している。 Marx's line は粘膜皮膚移行部の位置を示すため、この報告はこのライン自体が前方移動することを示している。これは MGD の存在と相関することが見いだされている。この加齢過程は、瘢痕性疾患において MCJ を横断して結膜の方にこの開口部を後方に引き寄せる過程とは対照的である。両変化とも、開口部は MCJ の後方に位置する結果となるが、そのメカニズムは明確に異なる。
進行と共に非瘢痕性 MGD は開口部の狭窄または閉塞および管周囲線維症となり( Fig. 10 )、その結果マイボーム腺脂質は瞼板への圧力では決して押し出すことができなくなる。この時点で、この症状が不可逆的であることが臨床的に報告されている。
瘢痕性 MGD は孤立した原発性の状態であり、非瘢痕性 MGD を併発することがあるが、一般的には、種々の形態の瘢痕性結膜炎(例、トラコーマ、多形性紅斑および類天疱瘡)を併発する。この場合、粘膜下の結合組織瘢 痕によって腺の導管が伸展、露出し、被覆した結膜粘膜が菲薄化する。これは導管露出と呼称され、瘢痕過程の特徴的な所見として若干隆起して肋骨状になる( Fig. 11, 12 )。病変部の開口部は MCJ を超えて瞼板まで後方に引かれ、ここで最終的に消失して見えなくなるか吸収される( Fig. 13 )。罹患した導管は多くの場合閉塞するが、時には、腺にかける圧力で透明なマイボーム腺脂質が圧出されることがある。罹患した開口部は粘膜中に位置するた め、輸送する脂質は涙膜の水層に放出され、それゆえ、涙液油層( TFLL )に効果的に関与することはないと思
われる。その状態は構造的および機能的に不可逆とみなすべきである。治療によって炎症性変化は抑制できるかもしれないが、解剖学的関係を回復することはできない。こういった状態でも、また MCJ は後方にゆっくり後退していく。
瘢痕性および非瘢痕性 MGD は瘢痕性結膜疾患がない場合には同じ眼瞼縁上に併発する可能性がある。
MGD の他の特徴には、円形化、陥没、くぼみ形成、末梢血管拡張、後部眼瞼縁の血管分布増加、腺開口部間の上皮隆起( Fig. 14, 15 )、開口部構造の消失、腺の胞状変化、腺房内の凝固形成、場合によっては霰粒腫の形成がある(付録 5 )。このような変化の自然経過と、その臨床疾患上の関連性は検討されていない。
B. マイボーム腺の臨床的評価方法:分類スケール
文献に示されている方法の中で、最も一貫して報告されているのは、腺の脱落を定量化してマイバムの質また は圧出性を分類する方法である。さらに圧出された分泌量も分類可能なパラメーターとして提唱されているが 90 、広く推奨はされていない。これは、圧出された量の測定であり、圧出されるマイバムの直径として記録され、用いられた力、および力をかけた時間に依存する からである。 MGD の定量化は、その重症度を評価して治療への反応をモニターするために重要である。また、臨床試験および自然経過の追跡は不可欠でもある。日本の MGD ワーキンググループが提唱している閉塞性 MGD の診断基準を付録 17 に示す。
マイボーム腺脱落:分類スケール マイボーム腺脱落は、部分的または全体的な腺消失または萎縮を示しており、マイボスコピー、マイボグラフィー、共焦点顕微鏡によって定量化が可能である( Table 3 )。 |
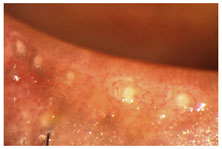
FIGURE 10. Advanced non-cicatricial meibomian gland dysfunction: dense orifice opacification with periductal fibrosis (courtesy of A. Bron).
|
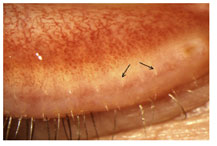
FIGURE 11. Cicatricial meibomian gland dysfunction: All meibomian orifices open onto the marginal conjunctiva, with some exposure of terminal ducts (arrows) (courtesy of A. Bron).
|
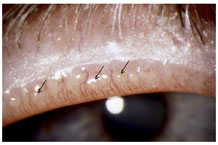
FIGURE 12. Cicatricial meibomian gland dysfunction: All meibomian orifices open onto the hyperemic marginal conjunctiva, with some exposure of terminal ducts (arrows) (courtesy of A. Bron).
|
|
From the 1 Department of Vision Sciences, Glasgow Caledonian University, Glasgow, Scotland, United Kingdom; the 2 Nuffield Laboratory of Ophthalmology, University of Oxford, Oxford, United Kingdom; 3 Korb and Associates, Boston, Massachusetts; the 4 Department of Ophthalmology, University of Tokyo Graduate School of Medicine, Tokyo, Japan; the 5 Southern California College of Optometry, Fullerton, California; 6 Private Practice, Houston, Texas; the 7 Department of Ophthalmology, Kyoto Prefectural University of Medicine, Kyoto, Japan; the 8 Department of Ophthalmology, Itoh Clinic, Saitama, Japan; and 9 Keio University School of Medicine, Tokyo, Japan.
Supported by the Tear Film and Ocular Surface Society (TFOS; http://www.tearfilm.org); individual author support is listed in the Appendix of the Introduction.
Submitted for publication December 6, 2010; accepted March 23, 2011.
Disclosure: Each Workshop Participant's disclosure data can be found in the Appendix of the Introduction.
Corresponding author: Kelly K. Nichols, College of Optometry , 338 W. 10th Avenue , Ohio State University , Columbus , OH 43210 -1280 ; knichols@optometry.osu.edu. |
|
|
| |
|
 |
|