| |
|
| Report of the Subcommittee on Anatomy, Physiology, and Pathophysiology of the Meibomian Gland |
page 2
Erich Knop, 1 Nadja Knop, 1 Thomas Millar, 2 Hiroto Obata, 3 and David A. Sullivan 4,5
マイボーム腺の幹細胞と細胞動態
マイボーム腺は、毛を伴わない大型の皮脂腺の特殊なタイプとして、より通常の皮膚の毛に付属する皮脂腺と共通した生物学と細胞動態の基 本ルール を持っ ている。しかし通常の皮脂腺に比べると、マイボーム腺の幹細胞と細胞動態に関する基本的知識は全般的にきわめて限られており、特にヒトでは限定的である。 このことは毛に付随しないもうひとつの皮脂腺である包皮腺にも当てはまる。したがって現時点では、皮脂腺の生物学のより一般的な現象を考察しなければなら ないことが 多く 、マイボーム腺におけるその妥当性が実験的に証明されることが待たれている。
マイボーム腺細胞の発生と移動
皮脂腺であるマイボーム腺は分泌産物( マイバム )を全分泌( holocrine )様式で産生する。すなわち、 Fig.4A に示すように、腺細胞全体の内容物が マイバム を形成するということである。脂質の合成と蓄積、中心方向への細胞の移動、最終的な細胞の変性と細胞膜の崩壊といった成熟過程を経た 後 、脂質およびその他の細胞内容物が導管系の内腔に吐き出される。こうした全分泌過程ゆえに、腺房には分泌細胞がぎっしりと詰まった構造をとり、分泌細胞が 継続的に 消失 しては置き換わっていくという動的結果をとる。この過程は、分泌産物のみが放出され分泌細胞はそのまま残る水分泌する涙腺の部分分泌( merocrine )様式とははっきりと対照をなしている 65 。腺房細胞が継続的に 消失 するためには、当然、新しい細胞の継続的産生、さらには、細胞の継続的ターンオーバーと腺房内での分化が必要となる。マイボーム腺細胞の再生は、基底膜上 にある基底細胞 66 の末梢層から起こると長い間想定されてきたが 67 、これはようやく 2001 年になって Olami らにより証明された 36 。より未分化で未熟な細胞が基底側に位置するという成熟勾配は、透過型電子顕微鏡でマウス 34 とヒト 35 のマイボーム腺で観察されており、組織学的にも示されている。
Olami ら 36 は、マウスのマイボーム腺で分裂しつつある細胞を放射性核酸の [3H]- チミジン(トリチウムチミジン)で標識した。いろいろな時点で観察した結果、標識された分裂細胞が最初は基底細胞層にだけしか存在しないことを示すことが できた。それより後の時点では、標識された細胞の数が徐々に増えていき、基底細胞が有糸分裂をして増殖していることが示された。その後は、標識細胞が腺房 の中心近くに存在することが観察されるようになり、このことからマイボーム腺細胞は求心性に移動するという仮説の正しさが証明された。マウスのマイボーム 腺では、マイボーム腺細胞の生成間隔は 4.1 日に 1 回分裂するという計算になる。新たに生成された細胞は基底層から腺房中心に向けて 1 日あたり 0.62 μm の速度で移動し、基底層を構成している時から最終的に中心部に押し出されるまでにおよそ 9 日かかる。以上の結果 36 は、マイボーム腺の前駆細胞が最初は基底層に位置しており、その子孫細胞が継続的・同時的に求心性の移動をすることを示している。この移動は、マイボメト リーで観察されているように 44 、マイバムが継続的に分泌されていることの説明になり、かつてから想定されていた継続的な分泌力 43 の根拠となる。分泌力とは、瞼板の外にある眼輪筋とマイボーム腺の終端部の周囲にあるリオラン筋との筋運動とを合わせて、脂質を瞼縁後部に排出する力であ る。同様の基本的特徴はヒトのマイボーム腺にも当てはめることができると考えられるが、ヒトの腺房は径が大きく、中に詰まっている細胞の数も多いので、具 体的な数値は若干異なる可能性がある。
マイボーム腺幹細胞
Olami らは、自らの観察所見に基づき、マイボーム腺の幹細胞は各腺房の 外 周に並んでいると結論した。マイボーム腺の幹細胞については今日までほとんど研究されたことがなく、例外として Olami らの 研究 と 1 本の抄録( Lavker RM, et al. IOVS 2003;44:ARVO E-Abstract 3781 ) が あるだけである。後者のグループは、マイボーム腺 の 幹細胞全般に関心があり、ブロモデオキシウリジン( BrdU: bromodeoxyuridine )または [3H]- チミジン(トリチウムチミジン)で標識して、細胞周期の速い細胞のほとんどが、マイボーム腺腺房基底細胞という意味の「基底皮脂腺細胞」に見られることを 報告した。しかし、彼らはこれらの細胞を、角膜輪部 69-71 や皮膚 72 の幹細胞や、造血系で定義される類似の細胞 73 と同じような、細胞周期の遅い細胞集団( slow-cycling cell population )として定義される真の幹細胞とは見なさなかった 68 。むしろその細胞を前駆細胞( transient amplifying cell : TA 細胞)と見なしている。 TA 細胞は幹細胞の娘細胞であり、急速に分裂するが、分裂回数には限界があり、分化プログラムも限定されていて 68 、最終的に分化細胞になるものである。腺房内に細胞周期の遅い幹細胞が観察されたとしてもそれはほんの数個しかないが( Lavker RM, et al. IOVS 2003;44: ARVO E-Abstract 3781 )、マイボーム腺の中で細胞周期の速い細胞はほとんどがその位置にあった。
さらに腺房外にある幹細胞の供給源から若い TA 細胞が遊走してきて継続的に補充されるということを仮定すると、基底上皮における細胞周期の速い TA 細胞の存在は、マイボーム腺細胞が継続的に発生するという説明として十分であると思われる。同様に、角膜上皮もおそらくは、角膜輪部にある幹細胞の供給源 に由来する TA 細胞の移動と分裂によって維持されており、角膜輪部幹細胞の不足が長時間続いても健全性を保つことができる 69-71 。同じことは、皮膚の上皮にも当てはまり、毛包内 68 または毛包間の表皮網状突出( epidermal rete pegs ) 74 にある幹細胞に由来する基底層 TA 細胞が数世代あり、それによって再生されている。
細胞周期が遅く、したがって標識が長く残存する推定上の幹細胞は、マイボーム腺の導管上皮に集中して見つかった( Lavker RM, et al. IOVS 2003;44:ARVO E-Abstract 3781 )。さらに、「マイボーム腺導管上皮の最上位にある」細胞の多くが急速に分裂する TA 細胞の目印となる標識期間を示した( Lavker RM, et al. IOVS 2003;44:ARVO E-Abstract 3781 )。こうした分裂能力の高い細胞は、遠く離れた瞼縁内側の粘膜皮膚移行領域にも見られる。
毛包との類似性 マイボーム腺でのこうした状況は、毛包の幹細胞と TA 細胞の配置(継続的な毛根上皮の下行と皮膚上皮の上行)と直接的な類似性を示している。 Cotsarelis ら 75 の観察によれば、毛 - 皮膚単位においては、細胞周期の遅い推定上の幹細胞は、毛包の中間位にある特定の領域(毛隆起( hair bulge ))にほぼ限定して存在している。この領域は毛包上部の固定部の端であり、立毛筋が毛包に付着する部位でもある。 Taylor ら 68 によるその後の研究により、 TA 細胞は毛隆起にある非常にゆっくり分裂している細胞周期の遅い細胞 (slow cycling cell) に由来し、 2 種類の異なった組織区画の中に存在するという最初の仮説が確認された。存在場所と細胞周期の特徴の違いから、その細胞は (1) 毛包下部と毛幹および (2) 毛包上部の上皮と表皮を形成することが結論づけられた。 |
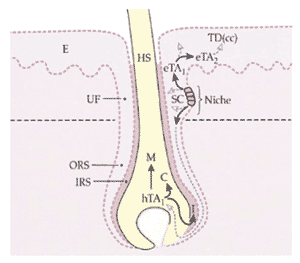
FIGURE 6. Stem cells in the hair follicle as a potential model for the meibomian gland. Stem cells (SCs) are located in the bulge area (Niche) of the outer root sheet (ORS) of the hair follicle. Two different populations of transient amplifying (TA) cells arise from this stem cell source and migrate ( solid arrows ) into two directions: hair-forming TA cells (hTA) migrate downward, whereas epidermis-forming TA (eTA) cells migrate upward. Both of them gradually differentiate and mature via different intermediate stages (TA1, TA2. . . to TAn) into the terminally differentiated cornified cells (TDcc) of the epidermis and hair, respectively. Inner root sheet (IRS) and (I); upper follicle (UF); hair medulla (M); hair shaft (HS); cortex (C); skin epidermis (E). In the bulge region and epidermis further differentiated cells generally move upward ( dashed arrows ) to the lumen. Schematic drawing of a section through the skin and a hair follicle. Reprinted from Taylor G, Lehrer MS, Jensen PJ, Sun TT, Lavker RM, Involvement of follicular stem cells in forming not only the follicle but also the epidermis, Cell , 102, pp. 451–461, ©2000 with permission from Cell Press.
|
したがって、毛隆起の幹細胞は二分化能を持ち、 2 種類の異なった分化経路を辿って、毛または表皮を形成する 2 種類の異なる TA 細胞集団になることができると結論づけられた( Fig.6 )。マイボーム腺において Lavker RM らが報告した結果( IOVS 2003;44:E-Abstract 3781 )も、毛包ですでに観察された状況とかなりの類似性を持つ 68,75 。管腔(毛包またはマイボーム腺導管)の内面を覆う上皮に細胞周期の遅い幹細胞領域があることに加え、より速く分裂し、分化している TA 細胞が 2 つの領域で見られる。 TA 細胞は下流(毛包下部およびマイボーム腺腺房内)と上流(毛包上部および、マイボーム腺外またはマイボーム腺導管の最上位部位の表皮と腺外の粘膜皮膚移行 部の表皮)に局在する。したがって、マイボーム腺において幹細胞と TA 細胞による上皮組織の更新の経過は、毛包のそれと類似していると考えたくなる。睫毛毛包とマイボーム腺との基本的な類似性は、なぜ過角化が MGD の典型的な病変なのかを説明する理由になるものであり、 Knop ら 24 が総説で述べているように、両者の類似構造および両者の共同する胎児発生 26-28 によってさらに実証されている。
細胞動態と機能的区分
考えられる限りでは、マイボーム腺は、細胞内伝達経路の分化制御で維持される独自の分化状態を必要と する少なくとも 3 つの構造・機能ドメイン( Fig.7 )を持つ。その構成は、 ( 1 ) マイバム の脂質を産生するマイボーム腺分泌細胞で満たされた腺房である全分泌型分泌区画、 ( 2 ) その脂質が排出される 4 層の扁平上皮からなる管状の導管系、 ( 3 ) 長い中央導管の最上端(遠位端)の部分で脂質を瞼縁後部に排出し、皮膚の多層角化上皮(表皮)の 伸展 部分にあたる排出導管、である。
こうした構造・機能区分の境界線を確立維持する方法は、現在のところ不明である。排出導管細胞・導管 系細胞・マイボーム腺分泌細胞の表面にはそれぞれ異なる受容体が発現すると想定される。そのうえ、それぞれの組織で異なる成熟と機能に関係して、細胞質内 のタンパク質の発現もそれぞれ異なることも考えられる。こうした説に関する詳しい情報は現在のところほとんど得られていないが、 Sullivan, Schirra らのグループ 76-81 がマイクロアレイアッセイを用いて、健常時および疾病時のマイボーム腺の遺伝子発現プロファイルに関する膨大なデータを作り出している。
皮脂腺における細胞動態
皮脂腺の発生は、その一部はマイボーム腺でも該当するが、これを統制する要因ヒエラルキーとして、 ( 1 ) 未分化幹細胞が皮脂腺幹細胞になる分化系列決定、それに続く ( 2 ) 増殖と腺構造への組織化、そしてその完成段階である ( 3 ) 腺房内の分泌細胞の最終分化と機能的脂質産生がある 82,83 。これらの各段階は、制御因子、特異性、相互作用によって統制されているが、現在でも解明が不十分である。
|
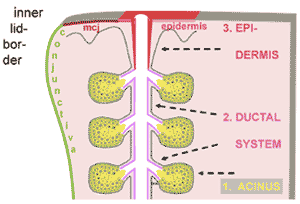
FIGURE 7. Structural and functional domains of the meibomian glands. The human meibomian glands are composed of at least three different structural and functional compartments. These are (1) the holocrine acinus with its basal cycling and luminal differentiating, lipid-producing meibocytes ( yellow ); (2) the four-layered stratified squamous epithelium of the ductal system (connecting ductules and long central duct), which has physiological incipient ( pink ) keratinization; and (3) the epidermis of the excretory duct, which represents an ingrowth of the stratified squamous, fully cornified ( red ) epidermis of the skin from the free lid margin. It can be assumed from studies of stem cells of the epidermis and of hair-associated sebaceous glands that each of these compartments is provided with lineage-committed progenitor cells. The basement membrane that separates the epithelial tissues from the underlying connective tissue is indicated by a dotted line . Schematic drawing of a section through a meibomian gland and the posterior lid margin, mcj, mucocutaneous junction [compare with Fig. 3]. Modified from Knop N, Knop E. [Meibomian glands, Part I: anatomy, embryology and histology of the meibomian glands]. Meibom- Drüsen, Teil I: Anatomie, Embryologie und Histologie der Meibom- Drüsen. Ophthalmologe . 2009;106:872–883 with the kind permission of Springer Science and Business Media.
|
皮脂腺幹細胞の在と分化系列決定 皮脂腺についてはかなり膨大な文献が存在するが、幹細胞からの皮脂腺組織の形成につい てはまだ十分に解明されていない。 Taylor ら 68 によると、毛隆起の幹細胞のうち上行移動して表皮に移る下位集団が、毛隆起から表皮への移動の途中にある皮脂腺の幹細胞にもなると考え得ることができる。 この考えは、分離移植した毛隆起幹細胞でもすべての皮膚分化系列を形成することができ、各種組織(毛包、皮脂腺、表皮など)を構成することができるという 研究 84,85 で支持される。最近の研究結果によると、毛包の間の領域(毛包間表皮)に由来する表皮幹細胞も、毛隆起幹細胞 68 に同じく二分化能細胞であり、 2 つの分化系列を形成する 86 。そのひとつが、角化マーカーを発現する表皮細胞への分化であり、もうひとつが転写因子 c-myc の影響下における皮脂腺細胞への分化である。別の研究 74 では、幹細胞の複数のクラスが毛隆起細胞からは独立して皮膚上皮に存在しており、毛や皮脂腺といった表皮構造の発生に寄与していることが示されている。こ の研究グループはさらに、マウスにおいてレトロウイルスによる lineage tracing を用いて、標識された毛単位のおよそ 3 分の 1 で皮脂腺のみが選択的に標識されたことを示した。このことは、もしかすると系統特異的な腺の幹細胞集団に該当する、寿命の長い slow cycling cells の存在することを意味している( Fig.8 )。腺前駆細胞に推定されるこれらの細胞は、腺房から毛包への移行帯に存在しており 74 、同じ場所において、マウスの皮脂腺に特異的な前駆細胞が後に転写因子により特徴付けられた 82 。この知見は、マウスのマイボーム腺では細胞周期の長い前駆細胞が導管上皮に存在することと若干対比的である( Lavker RM, et al. IOVS 2003;44:E-Abstract 3781 ) 87 。全分泌型の腺房幹細胞の存在場所の違いは、ヒトの毛包脂腺とマイボーム腺とは対照的に、マウスの毛包脂腺には一見したところ、明白な連結小導管がないという事実に関係している可能性がある。
現在では、皮膚には独立した幹細胞集団が少なくとも 3 種類あると考えられている 88 。すなわち、周期的に再生する毛の多能性毛隆起幹細胞、皮脂腺に対する系列に関係付けられた幹細胞 (lineage committed stem cell) 、そして毛包間表皮である。さらに、皮脂腺近くの毛包上部にある峡部滞在細胞がある。創傷のような病的状況の下では、毛隆起幹細胞が活性化して皮脂腺 82 と毛包間表皮 88 を実際に再度補充することが可能である。
皮脂腺の発生 転写因子 c-myc は、たくさんの遺伝子の発現を制御しており、なかには皮膚の発生に不可欠な遺伝子もいくつかある。皮膚において、 c-myc は幹細胞が角化する表皮細胞になるか皮脂腺細胞になるかを決定する、ある種のスイッチになる。 c-myc の発現が増大すると、皮脂腺細胞への分化が優位になる 83 。毛包間表皮の幹細胞でも c-myc を活性化することで皮脂腺細胞に分化させることが可能である 86 。
皮脂腺発生に約束された幹細胞のそれ以降の分化と増殖は、転写因子である B リンパ球誘導成熟タンパク質 1 ( BLIMP1: B lymphocyte-induced maturation protein 1 )で制御されている。この因子は元来さらなる増殖を抑制するが、 B リンパ球が抗体産生プラズマ細胞に分化することを促進する因子として発見された。マウスでの実験によると、腺房から毛包皮脂腺へ移動する時( Fig.8 )に BLIMP1 陽性の腺前駆細胞が失われると、毛隆起幹細胞区分の細胞活性が亢進し、腺組織が過形成の状態ながら再建される 74 。以上の観察データに基づき、 BLIMP1 陽性細胞は単能性の lineage committed 前駆細胞に該当し、皮脂腺の発生と恒常性を管理していると結論づけられた。しかしマウスとヒトのその後の研究において、皮脂腺・毛包・毛包間表皮に分化す る幹細胞は BLIMP1 で区別できるということは証明されなかった 86 。最近、 BLIMP1 タンパク質は実際には、毛包、爪、皮脂腺、表皮顆粒層といったすべての皮膚付属器で少なくともヒトでは出現することが分かった 89 。また、 BLIMP1 タンパク質は成熟したほとんどの細胞で主に存在することから、 BLIMP1 は最終分化において、例えば、表皮顆粒層に出現することで示されるように、皮膚バリアの恒常性での中心的機能といった重要な役割を持っていると著者らは結 論づけた 89 。しかし、 BLIMP1 をノックアウトすると、毛隆起にある多能性幹細胞の細胞分裂活性が亢進し、これは機能不全の皮脂腺細胞の代わりをしているようでもあり、 BLIMP1 の機能はもっと複雑かもしれない。これが起きると、皮脂腺の恒常性が乱れて過形成で拡大した腺が作られ、体毛が油っぽくなる 82 。その他の制御因子も、 Hedgehog 、 Wnt 、 Notch その他のシグナル経路を介して、皮脂腺細胞の分化と増殖に寄与する 90 。 Hedgehog 91 と Indian hedgehog 92 のシグナルは皮脂腺細胞の増殖を刺激し、このシグナルを抑制すると、腺の発生が抑制される。 |
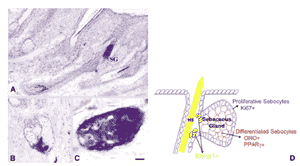
FIGURE 8. Location of sebaceous gland progenitors in the mouse skin. The expression of sebaceous gland– committed progenitor cells was found to be restricted to the transition zone between the acinus and the hair follicle in skin sebaceous glands. Such progenitor cells, labeled by retroviral transfer ( A – C ), are seen in a hair met in longitudinal section ( A ) as well as in cross-sections ( B , C ). Another marker (BLIMP1) that is assumed to characterize lineage-committed sebaceous gland progenitors indicates respective cells at the same position in a schematic drawing ( D ). ( A – C) Reprinted by permission from Macmillan Publishers Ltd: EMBO J , Ghazizadeh S, Taichman LB. Multiple classes of stem cells in cutaneous epithelium: a lineage analysis of adult mouse skin. 2001;76:1215–22, ©2001. ( D ) Reprinted from Cell, 126, Horsley V, O'Carroll D, Tooze R et al., Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland, 597–609, © 2006 with, permission from Cell Press. |
皮脂腺細胞の最終的な成熟 皮脂腺内での皮脂腺細胞の成熟に は、核内ホルモン受容体の PPAR サブファミリーの一員であるペルオキシソーム増殖因子活性化受容体 γ ( PPAR-γ: peroxisome proliferator activated receptor-γ )によるシグナルが関与している。これはリガンド活性型転写因子であり、脂質産生を行なう種類の細胞(ケラチノサイトも含まれる)を持つ多くの組織におい て遺伝子発現を制御する重要な役割を果たしており 93 、脂肪酸で活性化する 94 。 PPAR 類は、脂質代謝に関わるペルオキシソーム、ミクロソーム、ミトコンドリアといった細胞内小器官にある PPAR 応答エレメントを介して複数の脂質の代謝遺伝子を制御している 95 。 PPAR-γ は in vivo および in vitro での脂肪組織の分化に不可欠である 96 。 PPAR-γ へのシグナル(リノール酸などの長鎖脂肪酸)によって脂質産生と、大きな細胞内脂肪滴への蓄積が開始される 98 。 PPAR-γ は、ラットの毛に付属しない包皮腺の皮脂腺細胞の最終分化にも関与している 97 。皮脂腺の増殖と発達はアンドロゲン依存性だが、切除した細胞培養の実験において、皮脂腺細胞が完全に成熟するにはアンドロゲンだけでは不十分である 99 。アンドロゲンは皮脂腺細胞分化の早い段階(おそらく PPAR-γ のアップレギュレーションが含まれる)に影響を与えるようだが、皮脂腺細胞の完全な分化と成熟(典型的な大形脂肪滴の形成など)には PPAR-γ の働きが必要である 97 。したがって、アンドロゲンの作用は PPAR-γ に関係しているが、 PPAR-γ とははっきり異なっている。それでも、細胞培養において、ジヒドロテストステロンとそれに特異的な PPAR-γ リガンドであるチアゾリジンジオンの BRL-49653 はラット包皮腺の皮脂腺細胞の脂質産生の亢進に対して相加的に作用する 97 。このことは、皮脂腺機能の制御において性ホルモン(特にアンドロゲン)が重要であることを示している。
マイボーム腺での細胞の分化と動態
皮脂腺の分化と機能に関与する分子は、 Nien ら 87 の観察にあるように、マイボーム腺にも存在している。 BLIMP1 は皮脂腺系列の幹細胞の分化マーカーとして記載されたが 82 、後になって、表皮および基本的にすべての皮膚付属器で存在が観察されており 89 、マイボーム腺の導管系 87 と眼瞼表皮の内腔層でも見つかっている。皮脂腺細胞の分化マーカーである PPAR-γ もマウスのマイボーム腺で見つかっている。 PPAR-γ は加齢依存性であり、幼若動物では基底細胞の細胞質が染まり、若い成体ではほとんどのマイボーム腺細胞の細胞質が染まり、そして高齢動物ではすべてのマイ ボーム腺細胞の核が染まるとい うように 変化する 87 。こうした変化は、腺房の大きさと脂質産生量(オイルレッド O 染色で確認できる)が加齢と共に小さくなることと並行している。さらに、幼若動物と若い成体では、腺房基底細胞の多くが増殖能をもつことが Ki67 染色で確認できるが、高齢動物では増殖率が落ちてくる。上述の腺房基底細胞からの BLIMP1 の消失は、 BLIMP1 が当初考えられていたような 82 皮脂腺幹細胞の分化系列マーカーではないという最近の知見によって説明が可能だろうし、マウスにおける異なる分化系列の幹細胞を区別できるものではなく 86 、実際、ヒトの表皮では至るところに存在している 89 。
マイボーム腺細胞の最終分化は、皮脂腺の分泌細胞(皮脂腺細胞)のそれと類似性を有しており、そのことは両者の脂質産生の構造と機能か ら推測ができる。 PPAR-γ 依存経路を介して脂質が合成されたあとは、細胞内脂質は特別な区画(脂肪滴)の中で維持される。この区画には末梢のほうに脂肪細胞分化関連タンパク質( adipose differentiation-related protein : ADRP 、アジポフィリンともいう)も含まれている 100 。 ADRP はいろいろな細胞タイプの脂肪滴に見られる内因性の脂質貯蔵タンパク質であり、脂質を産生する細胞ならば、筋細胞から脂肪細胞に至るまで程度の差はあって もすべての細胞で見られる。 ADRP は長鎖脂肪酸の取り込みを促進し、自分自身の発現も、マイボーム腺脂質の主要成分であるこれらの脂肪酸が存在することでアップレギュレーション 101 される( Green-Church KB, et al. IOVS 2009;50:ARVO E-Abstract 533 ) 102-105 。 ADRP はノーザンブロットとウェスタンブロットおよび免疫組織化学染色によってラットのマイボーム腺組織で見つかっている 106 。免疫組織化学染色では、 ADRP が脂肪滴の周辺に局在しており、 in situ では腺房中心に向かって移動している成熟が進んだマイボーム腺細胞、分離マイボーム腺細胞の培養では成熟が進んだ細胞のほうが、一般に発現レベルが高いこ とが示された。したがって ADRP は成熟マイボーム腺細胞の分化マーカーになると考えられる。
幹細胞とマイボーム腺疾患との関連
幹細胞の形成やその遊走の異常は、 MGD とマイボーム腺疾患の両方に関与すると考えられる。この説の根拠は主に、皮膚の毛に付属する皮脂腺の観察によるものだが、マイボーム腺自体の知見にも基づいている。
皮膚では、そうした異常が問題となる(痊瘡 107 や脂腺癌の発症など) 108 。それに近い疾患は、マイボーム腺でも皮脂腺の過角化状態 7,109,110 と、マイボーム腺の癌 111 という形で起きる。
皮脂腺の変化は、 Horsley ら 82 の考察にあるように、幹細胞の分化系列決定から腺組織の完成、腺房内での最終的皮脂細胞の成熟に至るまでのいかなる段階でも起こり得る。表皮か皮脂腺形成 かの発生方向を切り替えるある種のスイッチである基礎転写因子 c-myc が過剰発現すると、皮脂腺の過形成が起こりやすくなり 112 、その結果、原発性脂漏症が起きると考えられている。さらに下流にある転写因子で c-myc を抑制してさらに前駆細胞の増殖も抑制するが分化は促進する BLIMP1 113 が、皮脂腺幹細胞の分化系列決定には不可欠である 114,115 。 BLIMP1 陽性で腺分化が決定した前駆細胞が消失して皮脂腺のホメオスタシスが乱れると、過剰な修復過程が起こり、過形成で膨満した腺と脂漏が起こる 82 。腺房内での皮脂腺細胞の最終的な成熟は、すべての脂質産生細胞にとって重要な因子である PPAR-γ で維持されている 98 。 PPAR が欠損した細胞、例えばノックアウト細胞は、分泌腺房の形成に不十分に関与するのみである 96 。皮脂腺についてのこうした考察を進めると、 PPAR-γ の発現パターンは幼若・若年成体マウスでの細胞質内局在から、高齢マウスの核局在に徐々に分布を変えることが考えられる。この局在部位の変化は、腺房全体 と特に個々のマイボーム腺細胞の中の脂肪滴が小さくなるという腺房萎縮の進行と平行して生じる 87 。したがって PPAR-γ の欠損はマイボーム腺の加齢関連の萎縮過程に関与している可能性がある。 PPAR-γ のアゴニストとアンタゴニストによって皮脂腺の機能を改変することができ、そこから治療法の可能性も開けてくる 87 。
傷した状態では、幹細胞の分化はより高度な可塑性を発揮する傾向があり 74 、分化系列決定が切り替わり、変化または消失した前駆細胞に置き換わることができるようになる 82,88 。この過程は MGD で見られる変化で、閉塞時での下方への機械的圧迫ストレスを伴う停滞によるストレスや繁殖した細菌からの細菌性リパーゼ、毒性のメディエータ、炎症メディ エータの下方放出によるストレスといったストレスを細胞に |
与える変化にも当てはまる。しかし、幹細胞による修復メカニズムは、本来の組織の再建という結果 が常に得られるわけではなく、構造と機能を変化させる可能性もある。こうした変化は、腺房過形成を起こし、脂質産生量を増やすことになり 82 、それが MGD の病態発生に関与している可能性が、痊瘡の病態発生で記述されているが 107 、同じくマイボーム腺癌の発生にも関与している可能性もある 111 。
マイボーム腺の脂質合成
概説
マイボーム腺での脂質の合成または取り込みに関する研究は数少ない。研究がわずかしかないことの主な理由は合成される脂質の種類に関す る情報がないからである。マイボーム腺の脂質の特性解明の研究は現在、きわめて長い脂肪酸を作る脂質合成経路の特定がようやくできるようになった段階であ る。しかしすべての動物モデルがヒトと同じ脂質混合物を産生するわけではなく、また、脂質産生に必要とするエネルギーやホルモン刺激についても完全には分 かっていないので、研究は未だに困難を抱えている。 2 個の炭素を結合して脂質鎖を伸ばしていくには莫大なエネルギーが必要である( ATP が 1 個と NADPH が 2 個 ; 炭素鎖が 16 個 のパルミチン酸の場合には ATP7 個と NADPH14 個が必要)。そのため、マイボーム腺は充分な酸素供給と確実な炭素源の両方が必要である。腺房基底細胞は毛細血管から酸素を利用することができるが、細胞 が成熟するにつれ細胞は徐々に脂質で膨満し、毛細血管から離れていく( Fig.4 )。グルコース(代表的な炭素源)と酸素は両方共に脂質内ではあまりよく拡散しない。したがって成熟しつつある腺房細胞にこれらの材料がどのようにして供 給されているのかについては謎が多い。成熟したマイボーム腺細胞においては、 Jester ら 32 によれば、「ミトコンドリアが縮んで高電子密度になっている」。それとは対照的に、 Golgas と Völkl 34 は成熟マイボーム腺細胞のミトコンドリア変性についてはなにも報告しておらず、マイボーム腺細胞の分化のすべての段階において好濃性の密な封入体が存在す ることのみを報告している。それにもかかわらず、細胞は脂質で満たされるので、脂質産生の材料は腺房中心の細胞に到達可能であるはずである。この過程が輸 送と拡散のどちらで起こるのかについては現時点では不明である。
また、脂質産生工程のホルモン制御についても、脂肪と糖の代謝にかかわるホルモンはインスリンとグルカゴンが一般的であるので、疑問が ある。これらのホルモンは水溶性であり、成熟しつつある腺房細胞にはわずかしか到達しない。それに対して、腺房細胞にはステロイドホルモン(特にアンドロ ゲン)が影響することが分かっており、脂溶性であるステロイドは成熟しつつある腺房細胞に到達ができるはずである。マイボーム腺の脂質合成の他にも、マイ ボーム腺細胞の超微細構造には積層した膜の集まりとペルオキシソームという特殊な特徴が見られる。これはその細胞が細胞内の膜系を合成するために極性脂質 (リン脂質やコレステロールなど)も合成しなければならないことを意味している。ただし、こうした極性脂質の中には、 (O- アシル )-ω- ヒドロキシ脂肪酸のように、分泌のために特別に合成されているものもあるという可能性は残る。膜系を合成する脂質と分泌のための特別な脂質との合成がどの ように制御されているのかの謎を解明する前に、正常マイボーム腺分泌物の構成成分についてコンセンサスが得られていなければならない。また、脂質合成に関 わる酵素の中には、研究が難しい膜結合性のものがある可能性がきわめて高い。免疫組織化学的な研究は酵素の局在判定に有用なので、このジレンマを解決でき る可能性がある。酵素分布は脂質の最終的運命を決定する重要な要因である。残念ながら、生化学経路について簡単に利用できるプライマー集は現在までに公表 されていない。
マイボーム腺脂質においてもっとも豊富にある成分はワックスとステロールエステルである。これらは脂肪酸と脂肪アルコール、長鎖(炭素 鎖 20 個超)脂肪酸とアルコール、それにステロール、特にコレステロールでできている。もっとも豊富にある脂肪酸はオレイン酸で、炭素鎖 18 個の一価不飽和脂肪酸( 18:1(cisΔ9 )であり、これは炭素 18 個のうち 9 番目の結合が二重結合であるという意味である。ワックスエステルは脂肪アルコールと脂肪酸の縮合で作られ、ステロールエステルはステロールと脂肪酸の縮合 で作られる 103,116 。理論的には、こうした脂質成分は腺房細胞においてデノボ合成されるか、血流から取り込まれるか、またはその両方があり得る。デノボ合成のエビデンスは、 それら成分の合成酵素や、最終産物を作るためのトランスエステラーゼが腺房細胞から直接的・間接的( mRNA )に検出されることで支持される 77,81,117 。脂質が血流から取り込まれるということの直接的なエビデンスは現時点では存在せず(これにはステロイドホルモンは当てはまらない。ステロイドホルモンは 脂質で、そのホルモン作用のひとつとして腺房細胞に取り込まれる)、この分野のさらなる研究が必要である。こうした取り込みは、食事内容の変化で脂質成分 が変化する可能性があるので、涙液およびマイボーム腺分泌物のコレステロール 118 またはコレステロールエステルと関連づけた血漿コレステロール値の研究がさらに必要である。最近、眼瞼炎患者で亜麻仁油( ω3 )を摂取している者は、血液中の ω-3 脂肪酸のレベルは高いにもかかわらず、 ω-3 脂肪酸、 ω-6 脂肪酸、総一価不飽和脂肪酸、多価不飽和脂肪酸、一価不飽和脂肪酸には違いがないことが示されている 119 。もし食事内容が重要ならば、脂質の食事摂取がきわめて限定されるコアラ(ユーカリ類の葉の単食性)のマイボーム腺脂質のプロファイルがその他の哺乳類と どうして同じなのかという説明ができない( Butovich IA, Millar TJ. IOVS 2009;50:ARVO E-Abstract 2545 )。しかし、シェーグレン症候群の女性患者には極性脂質プロファイルと食事内容の変動に相関があることが示されている。すなわち、 HPLC 分析で 1 つの極性脂質にピークがある患者は、複数の極性脂質にピークがある者に比べて、 ω-3 脂肪酸の摂取量がおよそ 2 倍であった 120 。したがって、マイボーム腺が分泌するすべての脂質は腺によって合成されることがもっとも考えられ、脂肪酸とコレステロールの合成、その経路に関与する中 心的酵素、それらが存在する細胞内局在について解明する必要がある。
脂質合成の概略
脂肪酸生成酵素で触媒される脂肪酸合成は細胞質で起こるが、炭素はミトコンドリア に由来する ( Fig.9 )。したがって、ミトコンドリアは脂質合成に必要な莫大なエネルギーを生み出すためだけでなく、脂質の炭素のためにも必要である。このことは、成熟した腺 房細胞が脂質で膨満するが、同時にミトコンドリアの数が減少し、酸素源から遠ざかっていくというマイボーム腺においては謎めいている。
脂肪酸合成
肪酸の炭素鎖は、酵素サイクルを繰り返した後の炭素 2 個で作られる。この過程の一部として 、 アセチル - CoA が活性化して高エネルギー状態にならなければならない。この活性化は、二酸化炭素を付加してマロニル - CoA を作ることで誘導される |
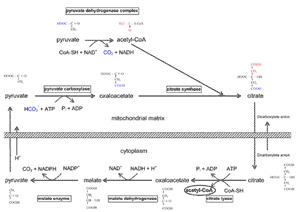
FIGURE 9. Transfer of carbons for lipid synthesis from the mitochondria to the cytoplasm. When the tricarboxylic acid (TCA) cycle in the mitochondria is blocked due to an excess of the high-energy molecule NADH, there is a buildup of mitochondrial acetyl-CoA that indicates to the cell that it has a surfeit of energy and therefore does not need to oxidize carbons to obtain more energy. Instead, it is more desirable to store the carbons as fats until the energy is needed. The acetyl group (2C) of acetyl-CoA is passed to oxaloacetate (4C) to form citrate (6C), and citrate is transferred across the mitochondrial membrane into the cytoplasm. It is then lysed (citrate lyase) and coupled to cytoplasmic CoA to form cytoplasmic acetyl-CoA, which is used for fatty acid synthesis, and oxaloacetate, which is cycled back (indirectly) to the mitochondrial matrix. Figure courtesy of Tom Millar.
|
される( Fig.10 )。脂肪酸合成のサイクルごとに、マロニル - CoA から 2 個の新たな炭素が脂肪鎖に付け加わり、 3 番目の炭素が CO 2 として放出される( F ig.11 )。脂肪酸生成酵素の異なるドメインで触媒される複数の異なる反応を通じて、サイクルごとに還元が 2 回起こり、そのたびに NADPH が NADP に変換される。その 2 回のそれぞれの段階は、 3 つの ATP を消費する点でほぼ同じである。結果は炭素偶数個の脂肪酸で、典型的には 16 炭素鎖(パルミチン酸)で、チオラーゼによって酵素から分離する。マイボーム腺にある脂肪酸の多くは 16 個の炭素鎖 よりも長く、それ以上に長さを伸ばすには異なる酵素が必要である。炭素奇数個の直鎖脂肪酸を合成する場合には、最初にプロピオニル - CoA (炭素 4 個 )が炭素源としてマロニル - CoA の代わりに用いられ、 CO 2 が外れ、脂肪鎖に炭素が 3 個付加されて、奇数個の脂肪酸が合成される。
直鎖脂肪酸 脂肪鎖を伸ばすには、パルミトイル ACP のパルミトイル部分がコエンザイム A ( CoA-SH: coenzyme A )に転移して、パルミトイル -CoA を生成する。さらなる伸長( C18-C28 )は、小胞体の中で起こり 121 、一部は別の酵素によって脂肪アルコールに変換される。伸長過程は上述と同じ方法で行われるが、この場合は CoA が担体となることが異なる。 2 個の新しい炭素がマロニル -CoA からパルミトイル -CoA に移され、続いて還元、脱水、還元を行なって、炭素 2 個だけ伸びた新しい飽和脂肪鎖が作られる。マイボーム腺分泌物の中でもっとも多い脂肪酸であるオレイン酸を生成するには、パルミチン酸( 16C )を伸長してから脱飽和しなければならない。脂肪酸 CoA 脱飽和酵素がアシル鎖に二重結合(ステアリン酸の 9 位結合)を導入してオレイン酸を生成する。この酸化反応は小胞体の内表面で起こり、シトクロム -b5 、 FADH2 、 NADPH を介した電子伝達系のカップリングが関与する。 NADPH は NADP + に変換される。哺乳類でのこの酵素は、 9 位と 10 位の炭素間の結合を容易に脱飽和するが、 10 位の炭素と末端のメチル基との間の結合は脱飽和しない。リノール酸( 18:2; all-cisΔ 9,12 )やリノレン酸( 18:3; all-cisΔ 9,12,15 )などの 10 位炭素と末端との間の脱飽和脂肪酸は通常は食事から得ている。こうした脂肪酸は少量ながらもヒトのマイボーム腺分泌物で検出されている 122 。マイボーム腺では、 18 炭素鎖脂肪鎖の ω-3 または ω-6 結合を脱飽和することができる他の |
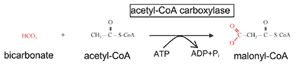
FIGURE 10. Formation of malonyl-CoA. Figure courtesy of Tom Millar. |
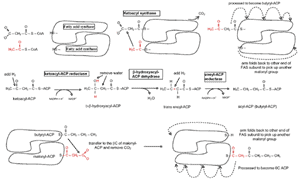
FIGURE 11. Various activities of fatty acid synthase. The functional enzyme is a dimer with multiple functions in different regions. On each cycle, the growing chain is transferred to a malonyl-loaded acyl carrier protein domain of the protein, and in so doing displaces CO2, which increases the chain length by 2C. Figure courtesy of Tom Millar.
|
酵素が働いている可能性がある。そうした酵素活性の 1 例として、動物に存在する fat-1 遺 伝子の産物がある 123 。こうした脱飽和酵素は膜結合型であり、その活性にはおそらくその他の膜リンク型補因子(シトクロム -b5 など)を必要とする。マイボーム腺腺房内で成熟が進んだ細胞には整ったペルオキシソームがきわめて多数存在していること 34 から、これらの酵素の局在がそこにある可能性があるが、まだ実証されていない。こうした酵素は膜結合型で精製が非常に難しいので、それらの存在を示す方法 としてはその遺伝子発現のほうが可能性が高い。その他に重要な点として、植物の膜結合型脱飽和酵素は基質にアシル -CoA ではなくグリセロ脂質を用いる。この基質の存在は同様の脱飽和( FAT-1 など)がマイボーム腺に存在するならば、やはりあり得る。この説は、炭素鎖源が小胞体の膜脂質に由来するということをイメージしたものである。
分枝鎖脂肪酸 マイボーム腺脂質の成分として、分枝鎖脂肪酸が いくつか検出されている 116,124,125 。放射性標識した前駆物質を用いたウサギのマイボーム腺の研究から、分枝を持つ炭素鎖は分枝を持つアミノ酸から供給されるようである。ウサギでは in vivo で主にイソロイシンが使われるが、 in vitro ではバリンも使われる。ロイシンが前駆物質として用いられた例は見つかっていない 126 。そのため、分枝鎖脂肪酸は(炭素鎖の ω 末端において)イソ型とアンテイソ型があるので、組み込みは脂肪酸生成酵素のアシルキャリアドメインの最初の装填時でなければならない。新たな炭素鎖は末 端のカルボキシル基側から伸長するので、最初に組み込みが行なわなければ、炭素鎖の全長に渡って複数の分枝が形成されることになる。同様に、組込みがより 長い脂肪酸を形成する伸長段階である最初のパルミチン酸合成の後に起こったならば、末端のカルボキシル基に近いところで複数のメチル基分枝がランダムに形 成される可能性があるが、これは実際にはない。分枝鎖脂肪酸の前駆物質アミノ酸の望ましい順序がその他の動物でもウサギと同じなのかどうかは、まだ分かっ ていない。
脂肪アルコール 脂肪アルコールはそれに対応する脂肪酸から合 成される。アシル -CoA の脂肪酸部分が還元されて(アシル -CoA 還元酵素)、対応する脂肪酸になる 127,128 。マイボーム腺での補因子が NADPH なのか NADP なのかは分かっていないが、反応に際しては 2 種類の高エネルギー物質が消費される。長鎖脂肪アルコールはコレステロールとワックスエステルに伴って見られる代表的な物質種なので、マイボーム腺では長 鎖脂肪酸が好んで使われるようである。この関連性は、酵素が長鎖脂肪酸を好むためか、短鎖脂肪酸がワックスエステルや (O- アシル )-ω- ヒドロキシ脂肪酸の成分として好んで用いられるためであろう 122 。脂肪アルコールの局在場所は、ペルオキシソームの中である可能性がある 34 。一方、他の組織のペルオキシソームはエステル結合の形成に関与する( 2 つのアルコールの縮合)が、マイボーム腺では、ワックスエステルを形成するために脂肪酸のエステル結合を形成している可能性が高い。
コレステロール合成 コレステロール合成の全体像は、炭素 27 個からなる物質はすべて、アセチル -CoA の形をした酢酸に由来することである。前述したように、アセチル -CoA のアセチル部分がクエン酸を介してミトコンドリアから細胞質に輸送される( Fig.9 )。次に HMG-CoA に変換され( Fig.12 )、メバロン酸に変換される( Fig.13 )。この反応を触媒する HMG 還元酵素は、インスリンで活性化され、グルカゴンで抑制される。したがって、未治療糖尿病患者のマイボーム腺脂質の成分の調査は興味深い。理論的には、こ の最も重要な酵素活性が低下していると考えられることから、コレステロール合成 |
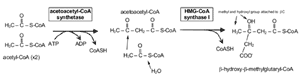
FIGURE 12. β-Hydroxy-β-methyl glutaryl-CoA (HMG-Co A). HMG-CoA synthase 1 (4.1.3.5) is located in the cytoplasm, unlike HMG-CoA synthase 2 (4.1.3.4), which is located in the mitochondria. Figure courtesy of Tom Millar.
|
合成が減少しているはずである。メバロン酸は炭素 5 個の物質、イソペンテニルピロリン酸に変換される( Fig.13,14 )。それが 3 つ連結して炭素 15 個の物質であるファルネシルピロリン酸を生成し、ファルネシルピロリン酸 2 個が連結して炭素 30 個の物質であるスクアレンが合成される( Fig.15 )。スクアレンは環化して、ラノステロールを形成し、メチル基 3 個が取り除かれてコレステロールになる。
この経路に関与する酵素の mRNA が、マウスのマイボーム腺抽出物で検出されており、そのほとんどがテストステロンで増加する。このことは、この経路がテストステロンでアップレギュレー ションされていることを示している 77,121 。この想定の根拠は、マイボーム腺腺房細胞の中にさまざまな種類のヒドロキシステロイド脱水素酵素が組織化学的に検出されていることである。これらの酵素 は発達中および成熟時のマイボーム腺腺房細胞に存在するが基底部にはない 129 。また、これらの酵素は、顔面と頸部の皮脂腺には見られるが、それ以外のすべての皮脂腺で見つかっていない 130,131 。皮脂腺においては、これらの酵素のレベルが加齢とともに低下するが、マイボーム腺ではそうならないようである。 Perra ら 56 は 18 歳から 60 歳までの被験者からサンプルを採取しているが、そのことには言及していない。機能の面では、これらの酵素は小胞体に位置し、アンドロゲンを強力な代謝形 式、特にジヒドロテストステロンに変換させることができる。ジヒドロテストステロンは、脂肪酸とコレステロールの合成など脂質代謝に関連する酵素の遺伝子 の転写を上昇させることに関わっている。
その他の合成経路
トリグリセリドもマイボーム腺脂質の成分として報告されている。トリグリセリド合成の経路には、解糖系の中間体のひとつであるジヒドロ キシアセトンリン酸が関わっており、変換されてグリセロール三リン酸になる(グリセロール 三 リン酸脱水素酵素)。この反応には水素源として NADH が用いられる。アシルトランスフェラーゼが次々とアシル基をアシル - CoA からグリセロール三リン酸の C 1 、そして C 2 と転移させ、ホスファチジン酸を作る。ホスファチジン酸ホスファターゼがホスファチジン酸を脱リン酸化して、ジアシルグリセロールを生成する。次にこれが アシル - CoA からのアシル基の転移によりトリアシルグリセロールになる(アシルトランスフェラーゼ)。
マイボーム腺で最近になって (O- アシル )-ω- ヒドロキシ脂肪酸が検出 33,121 されたことから、 ω- ヒドロキシ脂肪酸がマイボーム腺で合成されなければならない。 ω- ヒドロキシ脂肪酸の酵素経路は不明である。この段階では、長鎖 ω- ヒドロキシ脂肪酸のみが検出される。これは水酸化がアシル鎖合成の最後に起き、最初ではないことを示していると思われる。不活性な末端メチル基の水酸化は きわめて稀であり、通常は何種類かの中間体を必要とする。そうした中間体はまだ検出されていない。しかしそうした物質の多くは、微量の可能性があり、特に それを目指して探索しない限り見つからないだろう。 |
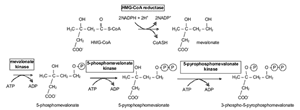
FIGURE 13. Formation of 3-phospho-5-pyrophosphomevalonate. 3-Hydroxy-3-methyl glutaryl-CoA is converted on the endoplasmic reticulum to the energetically activated 3-phospho-5-pyrophosphomevalonate. Figure courtesy of Tom Millar.
|
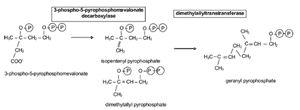
FIGURE 14. Formation of 10C geranylpyrophosphate. The 5C isopentenylpyrophosphate and its isomer are formed from 3-phospho-5-phosphomevelanate, which are then joined to form 10C geranylpyrophosphate. Figure courtesy of Tom Millar.
|
コレステロールエステルは長鎖(炭素 20 個超)脂肪酸がそれに付着する傾向があり 132 、関与するコレステロールトランスアミラーゼが長鎖脂肪酸を好むことを示している。こうした好みは、炭素鎖長をえり好みしないワックスのアシル -CoA: アルコールトランスアシラーゼとは違っている 125 。 (O- アシル )-ω- ヒドロキシ脂肪酸は C18:1-FA による ω- ヒドロキシルを介してアセチル化された長鎖 ω ヒドロキシル脂肪酸( C30:1 、 C32:1 、 C34:1 )になる傾向があり 132 、このことは、トランスアシラーゼがきわめて特異的であることを示している。
マイボーム腺での脂肪合成に関するコメント
血管の供給 脂肪合成にはエネルギーと、酸素源となる大量の血 液供給を必要とする。こうした必要性は脂肪組織の発生には反映されており、脂肪細胞の密度は毛細血管の密度と正に相関し、脂肪細胞は大血管周辺に凝集する 傾向がある 133 。マイボーム腺の構造に関する既存の文献とマイボーム腺発生の構造的研究を調査したところ、毛細血管の太さや密度には特別の関心はもたれていなかった。毛 細血管の研究は、発生において特に必須というわけではないが、腺の萎縮が見られる加齢変化の理解には有益になり得る。マイボーム腺導管が閉塞した時などに 起きる局所的腫脹も、血流を低下させ、腺の萎縮を引き起こす要因になるかもしれない。その他の脂肪細胞では、 PGE2 (遍在性)や L- ブチリルグリセロール(脂肪細胞に特異的)といった血管新生因子が脂肪細胞によって合成され、分泌される。マイボーム腺細胞によるこうした因子の分泌は、 今日まで研究されていない。
こうした合成経路の主なエネルギー源は NADPH であり、一般的には解糖系の側路であるペントースリン酸経路で生成される。この経路に関与する中心的酵素(グルコース -6- リン酸脱水素酵素と 6- ホスホグルコン酸脱水素酵素)は、ヒトのマイボーム腺の分化段階および変性段階の細胞で検出されているが、基底細胞からは検出されていない。この経路の必 要性は、マイボーム腺細胞が脂質を産生するには豊富なグルコース供給が必要であり、したがってグルコース取り込みについてインスリンと豊富な血液供給に大 きく依存していることを意味する。インスリンも脂肪合成を促進する(脂質合成酵素の活性を制御するキナーゼ類の多くは、インスリン感受性である)。同様 に、グルココルチコイドも脂肪組織量を肥大効果により増加させることが昔から知られている。クッシング症候群患者もしくはコルチゾール治療を受けている患 者のマイボーム腺を評価することが、この仮説を検証する臨床的方法になるだろう |
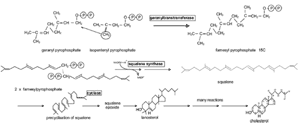
FIGURE 15. Formation of cholesterol. Formation of 15C farnesyl pyrophosphate, followed by 30C squalene, which is then converted through a variety of reactions to 27C cholesterol. Figure courtesy of Tom Millar.
|
腺房細胞間の膜は他にはないくらいに特別に嵌合しており 35 、細胞質の交換が行われている可能性がある。それに賛同する側としては、非公式の考察として、ミトコンドリアが脂肪滴の周囲に密集していて、ミトコンドリ ア由来の分子が新しい脂質の炭素源になっていることに合致する像が、発表された顕微鏡写真で示されている 32 。同様に、一部の脂肪滴は小胞体の組織化された密な層に囲まれている。こうした配置は、脂肪酸鎖の伸長と酸化(二重結合の形成)に関与する酵素がこうした 領域に存在していることに合致する。また、この段階では異なる脂質が異なる脂肪滴に収まっていることを示しているとも考えられるが、最終的に全分泌の一環 として細胞が崩壊するので、結局は影響がないものと考えられる。
|
|
|
|
|
| |
|
 |
|