| |
|
| Report of the Subcommittee on Anatomy, Physiology, and Pathophysiology of the Meibomian Gland |
page 4
Erich Knop, 1 Nadja Knop, 1 Thomas Millar, 2 Hiroto Obata, 3 and David A. Sullivan 4,5
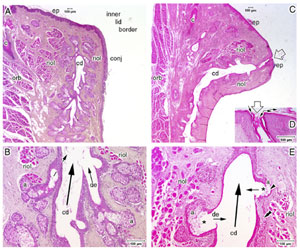
FIGURE 18. Comparison of the structure of a normal and an obstructed human meibomian gland. ( A, B ) A histologic section through a normal meibomian gland at the inner lid border. ( A ) The terminal part of the central duct (cd) and the terminal acini are encircled by fibers of Riolan's muscle (riol), which represents the marginal inner part of the orbicularis muscle (orb) and is split by the downgrowth of the ciliary (c) hairs [compare with Fig. 5]. The free lid margin is covered by the keratinized epidermis (ep), which transforms at the inner lid border into the conjunctival mucosa (conj). The section does not pass through the orifice of the central duct (cd). ( B ) In a magnification of ( A ), it is seen that the connecting ductules (de) from the acini (a) of a normal gland are typically narrow and enter the central duct in an oblique direction. ( C–E ) Section through a meibomian gland with obstructive MGD. ( C ) The orifice ( open arrow ) is in the typical position, still within the keratinized epidermis, which extends for about half a millimeter into the central duct and forms an excretory duct. Even though the obstruction is not very advanced, as judged from the moderate dilatation of the central duct (cd), there are distinct alterations of the gland structure. The cd is already partly dilated, the epithelium of the wall is thinner than in the normal gland, and the wall is partly undulated. ( D ) The orifice is obstructed by numerous keratin lamellae ( small arrows ). ( E ) The secretory acini (a) are distinctly smaller and more roundish than in a normal gland, whereas the ductules (de) are dilated and enter the central duct (cd) at about right angles ( small arrows ). An atypical lumen ( asterisk ) has formed within the acini, and the secretory meibocytes are reduced in number and form only a few remaining cell layers ( arrowhead ). In one location, the residual meibocytes of a presumably disrupted acinus appear integrated into the wall of the central duct ( double arrowhead ). Inflammatory leukocytes are not apparent. Taken together, these findings indicate atrophy of the dilated meibomian gland. Light microscopic images of paraffin-embedded sections stained with hematoxylin and eosin (H&E); size markers are shown in the images. Reprinted from Knop E, Knop N, Brewitt H et al. [Meibomian glands, Part III: meibomian gland dysfunction (MGD)—plaidoyer for a discrete disease entity and as an important cause of dry eye.] Meibom-Drüsen, Teil III: Meibomdrüsen Dysfunktionen (MGD)—Plädoyer für ein eigenständiges Krankheitsbild und wichtige Ursache für das Trockene Auge. Ophthalmologe . 2009;106:966–979 with the kind permission of Springer Science and Business Media.
|
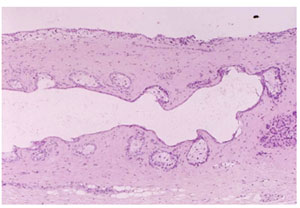
FIGURE 19. Cystic dilatation of a human meibomian gland. In cystic dilatation due to obstruction of the meibomian gland orifice, the ductal system is distinctly dilated, together with a dilation of the connecting ductules and atrophy of the acini. Figure reprinted from Obata H, Horiuchi H, Miyata K, Tsuru T, Machinami R. Histopathological study of the meibomian glands in 72 autopsy cases (in Japanese). Nippon Ganka Gakkai Zasshi. 1994;98:765–771 with permission from the Japanese Ophthalmological Society. |
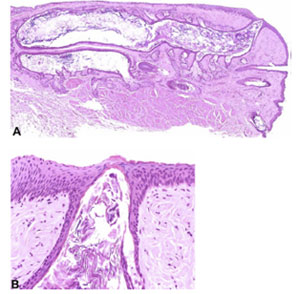
FIGURE 20. Epinephrine-induced MGD in rabbit. ( A ) The lumina of the dilated ducts are filled with keratinized material, representing keratin lamellae that are shed from the hyperkeratinized ductal wall. ( B ) The epithelium of the orifice was also hyperkeratinized and obstructed. Figure courtesy of Hiroto Obata. |
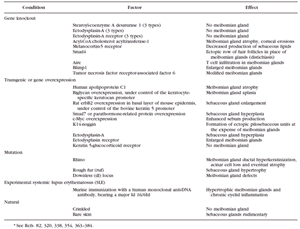
TABLE 4. Possible Mouse Models of MGD, MGH, and Evaporative Dry Eye Syndrome*
|
より発症させるものである( Table 4 )。得られている系統は、さまざまな表現形を持ち、例えば導管の過角化、腺房の消失、進行性の腺房萎縮、マイボーム腺消失、腺拡大などがある( Table 4 )。これらのモデルの一部は、蒸発亢進型ドライアイとそれに対応する眼表面続発症の研究によく利用されている。この説に合致する所見としては、アシル - CoA :コレステロールアシルトランスフェラーゼ -1- ノックアウトマウスにおけるマイボーム腺萎縮とそれに伴う角膜びらん 366 、および X 連鎖性遺伝の減汗性ないし無汗性外胚葉形成不全マウスにおけるマイボーム腺欠損とそれに伴うことが多い角膜欠損(新血管形成と角化など)および眼表面炎症 である 367 。しかしこれらのモデルにおける眼表面の問題は、ひとえに腺の障害に依存しているわけではなさそうである 367 。 |
皮脂腺の構造と機能に顕著な変化を示すそれ以外のマウスモデル 82,320,338,354,363-384 ( Table 4 )も MGD や MGH のモデルになりうるが、その可能性の評価はまだ行われていない。
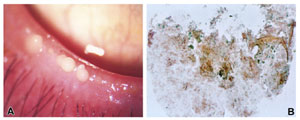
FIGURE 21. Features of pathologic meibum. ( A ) Yellowish white, turbid meibum from a 72-year-old woman. ( B ) Impression cytology of yellowish white, turbid meibum from a 71-year-old man. An orange, keratinized material is seen on the nitrocellulose membrane. Cellular components such as inflammatory cells are not seen. Papanicolaou staining. Figure courtesy of Hiroto Obata.
マイバム の細胞学:マイボーム腺分泌物
正常 な マイボーム腺分泌物(すなわち マイバム )は透明であると 考えられ ているが、濁ったり、濃縮していたり、練り歯磨き程度の粘稠性 を 持つことがある( Fig. 21A )。
濁ったマイバムの細胞学的性状を調べるために、 Obata らは大規模研究として、 60 歳以上の高齢患者 50 人を対象にしてマイバムのインプレッションサイトロジーを行なった( IOVS 2002;43:ARVO E-Abstract 60 )。その結果によると、ほぼすべての
|
ほぼすべての症例で角化物質が存在しており、その物質は Korb と Henriquez 3,356 が最初に記述し、後に Ong ら 385 が生化学および免疫学の手法で分析したものによく似ていた。炎症細胞は炎症の存在を示す根拠になるものだが、炎症細胞はほとんどの症例で見つからなかった ( Fig.21B )。このことは、それまでの組織学で観察されていたように 31,357,358 、少なくとも炎症性白血球の遊走に基づく炎症が閉塞性 MGD の主原因ではないことを示している ( Obata H, et al. IOVS 2002;43:ARVO E-Abstract 60 )。 マイバムに炎症細胞がないことで、腺房周囲の炎症変化は完全に除外されるものではない。しかし、明白な腺の炎症の相対的欠如は、過角化が閉塞性 MGD の発症機序の主な要因のひとつであるという考えを支持している。
Obata ら( IOVS 2002;43:ARVO E-Abstract 60 )はマイバムをその外観で、油状、クリーム状、練り歯磨き状の 3 つのグループに分け、色を黄色、黄白色、白色の 3 つに分類した。細胞学的特徴は、マイバムの性状や色に関わらずすべてのグループで同じであった。この知見は、マイバムの濃さと色の変化は脂質成分の変化を 反映したものであって、角化の程度を反映したものではないことを示している。色の変化は脂質の過酸化によるものではないかと推測している。
現在では閉塞性 MGD は、すでに述べたような複数の内因性および外因性の要因に応じて、排出導管と開口部の過角化によって生じると考えられている。分泌されたマイボーム腺脂質 は常在細菌が作る酵素(リパーゼやエステラーゼなど)によって変化することがある 41,353 。細菌は眼瞼縁に存在しているが 42 、健常者および眼瞼炎患者 42 で圧出された新鮮なマイバムからも培養される 353 。こうした細菌の酵素によって、遊離脂肪酸などの脂質分解産物が作られ、それが表皮を刺激して角化をより一層刺激することが眼瞼縁 41 では想定されており、皮膚では実際に証明されている 386 。変化した脂質成分は融点も上昇させる可能性があり、そのために粘性が高い脂質が脱落した上皮細胞と混じり合い、閉塞性 MGD が起きることも考えられる。
その一方で、ホルモンバランス異常などの場合で 223,257,259 、マイボーム腺の腺房上皮細胞の脂質合成が変化して、脂質プロファイルが変化する可能性もある。こうした変化がマイボーム腺閉塞に寄与する程度については、今後確かめる必要がある。
腺房の萎縮
閉塞性 MGD の臨床像はマイボーム腺でもっとも多く見られる病理変化である過角化と腺の閉塞が原因であることを示す報告が多数あるが、それに加えて、眼瞼内部の組織が 徐々に崩壊し腺が変性して萎縮する場合があるというエビデンスもある 3,31,356,357,387 。萎縮変性は、継続して産生される分泌物の貯留のために腺の内圧が亢進することで説明できる。他の器官でみられるように、加齢とともに萎縮が起こるという エビデンスもある 53,358,387 。
加齢の影響 自然な加齢過程では、 Hykin と Brons 348 が記述したように瞼縁後部の変化が増大するだけでなく、活動性の腺の数も減少し、それは生体染色 50 、診断的圧出 50 、確認できる腺組織の減少(腺脱落) 53 で示される。 Norn 50 は、活動性の脂質を排出する腺の数が 20 歳代から 80 歳代にかけて半減することを示した。しかし、眼瞼縁での脂質の量はほぼ安定していて、むしろ若干増えるくらいである 44 。これは眼表面からの排出が異なる動態をとるために 4 、高齢者の脂質の消失は若年者よりも抑えられるからと考えられている 37 。
Nien らの最近の研究により、マウスのマイボーム腺への加齢の影響が調べられた 87 。それによると、脂腺の成熟において不可欠な因子が変化することによる腺の萎縮性変化という意味での腺機能低下を示すいくつかの兆候が観察されている。マ イボーム腺基底層において、増殖する細胞の有糸分裂が加齢とともに顕著に減少することが、 Ki67 の免疫染色で示されている。こうした減少に並行して、腺房の大きさが小さくなり、マイボーム腺細胞の成熟マーカーである PPAR-γ の発現の局在が、幼若個体( 2 か月齢)および若い成体( 6 か月齢)の細胞質内から、高齢個体( 2 歳)の核内に移動する。また、幼若個体では多数の小さな脂肪滴があるが、高齢個体では数少ない大きな脂肪滴になっており、脂質産生が減少することがオイル レッド O 染色で確認された。さらに、 BLIMP1 および骨髄細胞のマーカー分子である CD45 陽性細胞が腺房周囲に観察された。高齢個体で起こり、そして増加した白血球浸潤の反映だと考えられるこの細胞の増加は、萎縮性変化に伴う事象を意味してい るのかどうか、それとも腺萎縮の発症や進行の原因のひとつとして関与しているのかは、これらの観察所見からは不明である。
ヒトでの加齢に伴う変化は、 Obata ら 358,387 が報告している。それによると、マイボーム腺で見られる病理所見のひとつが、明らかな導管の拡張を伴わない腺房萎縮であり、このことから、腺房萎縮が原発 性に生じ、それによって加齢に伴うマイボーム腺分泌物の減少が引き起こされる可能性が示された。萎縮腺房は、正常腺房の丸い形とは違って腺房が小型で不整 形になる( Fig .22 )。ヒトでの加齢に伴う変化は、 Arita ら 53 も報告している。彼らは、赤外線マイボグラフィーの技術を用いて 30 ~ 80 歳代で、加齢に伴いマイボーム腺の脱落(瞼板内の腺組織の消失)が非常に増えることを示した。この増加には TBUT の短縮が伴う。この腺脱落が腺組織の生理的消失を意味しているのか、周囲の瞼板組織の性質が変化したために見えなくなったのかどうかは、現時点では不明で ある。その後、同じ研究グループが CL 装用者でもマイボーム腺脱落率が高いことを観察した 355 。若年の CL 装用者の脱落率は 80 歳代の健常者のものに匹敵していた。この脱落率は CL 装用時間数に依存していたが、 CL の種類には無関係であった。 CL 装用者における腺脱落の病態発生機序は、 Arita ら 355 が考察しているようにまだ分かっておらず、閉塞性変化の他にも、結膜と瞼板組織の慢性的な機械的障害も考えられている。巨大乳頭結膜炎で見られる炎症変化 によってもやはり腺脱落に至ることがある 388 。したがって、 Knop と Knop 389 が考察しているように、結膜から瞼板を通過してマイボーム腺に至る経路に存在する炎症メディエータが、腺脱落や、もしかすると腺萎縮にも寄与している可能 性が考えられる。
マウスのマイボーム腺における加齢性の萎縮変化 87 は、閉塞性 MGD で典型的に見られる腺房萎縮の変化とは異なっており、導管と腺房のよく知られた過角化と拡張が見られない 3,4,31,357,358 。ヒトで時に観察される原発性と想定される萎縮とこれがどう関係するのかは、現時点では不明である 358,385 。このように、げっ歯類の加齢に依存した萎縮と、病理的閉塞に起因する萎縮とでは萎縮のメカニズムに明らかな違いがある。しかし、いずれの萎縮変化でもマ イボーム腺による脂質の産生が減少して、下流の眼表面と涙液層に対して負の影響を与える可能性が強い。
徐々に腺機能が低下していく原発性の加齢に伴う MGD の病態 358 ( Fig.22 )が存在する可能性を考える必要はあるが、 MGD の主な病態はおそらく過角化による腺の閉塞に起因す するものであり、拡張が特徴的な所見として表われる( Fig.18,19 )。 |
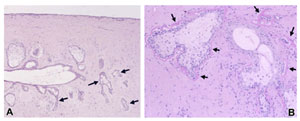
FIGURE 22. Acinar atrophy of human meibomian gland. ( A ) Acinar atrophy: Atrophic acini show a small and irregular, not rounded, shape ( arrows ); the duct appears slightly dilated. No inflammatory cell infiltration is seen. Figure reprinted from Obata H, Horiuchi H, Miyata K, Tsuru T, Machinami R. Histopathological study of the meibomian glands in 72 autopsy cases (in Japanese). Nippon Ganka Gakkai Zasshi . 1994;98:765–771 with permission from the Japanese Ophthalmological Society. ( B ) Basement membrane thickening of the acini: Basement membrane thickening ( arrows ) is frequently associated with atrophy of acini. Periodic acid-Schiff (PAS) staining. Figure courtesy of Hiroto Obata.
|
萎縮変化は眼のその他の腺でも見られ、例えばヒトの涙腺の腺房萎縮も主に高齢者の組織で見られる 390 。唾液腺では自律神経支配除去およびボツリヌス毒素の腺内注射による一過性の除神経状態で、腺房萎縮が起こる 391,392 。 Straatsma 31 は、マイボーム腺開口部の閉塞により導管と腺房が拡大しようとするが、瞼板の密な結合組織からの抵抗にあうために、嚢胞性変化が起きると考察している。最 後には、嚢胞の内圧亢進によって細胞分化が阻害されるかもしれないとしている。その他の組織に目を向けると、例えば唾液腺では導管を結紮で閉塞させると萎 縮が起こることが良く知られており 391 、これはマイボーム腺で起きているメカニズムと同じメカニズムによる影響だと想定することができる。前立腺と膵臓では虚血と低酸素が萎縮を引き起こす 392,393 。こうした現象は廃用性萎縮としてよく知られたものであり、腺の閉塞の一般的な結果である。
腺房の基底膜の肥厚 腺房の萎縮に伴って腺房の基底膜の肥厚がしばしば見られ、これはヘマトキシ ン・エオジン( H&E: hematoxylin and eosin )染色で確認できるが、過ヨウ素酸シッフ( PAS: periodic acid-Schiff )染色でより一層はっきりと観察できる 387 ( Fig.22B )。基底膜の肥厚が原発性なのか腺房萎縮後の続発性変化なのかは不明である。いずれの場合でも、基底膜の肥厚によって腺房周囲の毛細血管からの血液供給が 阻害され、マイボーム腺のホメオスタシスに負の影響があると考えられる。
血液供給の影響 瞼板の中には太い血管がなく、通常の H&E 染色したパラフィン包埋切片では、あまりよく見えない。瞼板内の血管は、血管内皮マーカーを用いた免疫組織化学でもっともよく観察できる。この標識によっ て、腺房周囲の毛細血管が観察でき( Fig.23 )、それがマイボーム腺の栄養供給に寄与していると考えることができる。
炎症
McCulley ら 394 は、 原発性 マイボーム腺 炎 はそもそも感染の 実体はないようである が、全身性の皮脂腺機能不全の一面を表すと主張した。 MGD における炎症 の定義と関与が不明確であるのは
、いくつか理由がある。その第 1 が、後 部 眼瞼 炎 ( posterior blepharitis )、マイボーム腺炎( meibomitis )、 MGD など 相互交換可能な用語が複数併存しており、病態の明確な区別が曖昧だからである。第 2 が、炎症をどのように定義するかという議論がまだ続いているからである。炎症の定義は、古典的病理学 のように 炎症細胞の浸潤で定義することもできるし、現代分子生物学 のように 炎症細胞浸潤が光学顕微鏡で観察できなくとも炎症性サイトカインの関与で定義することもできる。後者の状態は、明らかな炎症の対語としての前炎症状態であ ると言え、組織の分化を変化させる能力がまだある。第 3 が、炎症は感染性と非感染性の 2 つに大きく分けることができるからである。検出された細菌が健常者にもいる常在細菌であり、大量とはいえ眼瞼炎患者で検出されたならば、それは感染という より増殖を反映している 42 。こうした所見を統一した定義が提唱されている。
MGD におけるマイボーム腺への炎症細胞の浸潤に言及した論文は現在までに少数しかない。剖検から得た瞼板組織の病理組織学研究によれば 358,387 、脂肪肉芽腫性炎症と、炎症細胞浸潤を伴う肉芽組織が観察された。しかし、こうした変化が MGD の病理所見に当たるのかどうかははっきりしていな |
|
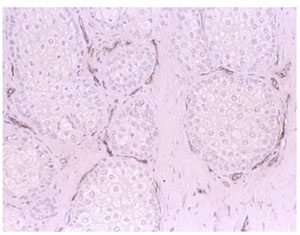
FIGURE 23. Capillary vessels in a normal human meibomian gland. Immunostaining of factor VIII, a marker of vascular endothelial cells, reveals capillary vessels surrounding the acini. Figure courtesy of Hiroto Obata.
|
たるのかどうかははっきりしていない。現在までに発表された研究においてはマイボーム腺の嚢胞性 拡張と腺萎縮があった標本に炎症細胞浸潤は観察されていないことに留意することは重要である 31,357,358,387 。一方、生体共焦点顕微鏡によって眼瞼炎とマイボーム腺炎の患者の眼瞼結膜上皮と間質の炎症をみた報告からは、炎症性浸潤の有無で MGD とマイボーム腺炎との鑑別が可能であることが示唆されている 395 。別の生体共焦点顕微鏡研究では、閉塞性 MGD 患者の眼瞼で腺周囲の炎症細胞浸潤が観察され、その浸潤はレボフロキサシン点眼、フルオロメトロン 0.1% 点眼、および経口ミノサイクリン治療で消失した 396 。しかし共焦点顕微鏡では個々の細胞型の鑑別が困難であり、活性化した間質細胞と白血球とを明確に鑑別することができないことも多い。このように、生体共 焦点顕微鏡は炎症の有無を、組織病理学で達成されるほどには明確に判断することができない 3,31,356,357,387 。
閉塞性 MGD で腺の内圧が亢進すると、導管と腺房の上皮は細胞ストレスを受ける。そうしたストレスでマイボーム腺の MAP キナーゼ活性が誘発され、その結果ケモカイン類とサイトカイン類が放出され、最終的に角結膜上皮で観察される炎症の発生に至ると推測されている 397 。 MGD における炎症の関与について今後さらなる研究が必要である。
感染と治療
MGD の病態生理は複雑であり、細菌感染が MGD の原因のひとつかどうかは、まだ結論が出ていない。コアグラーゼ陰性ブドウ球菌( CNS: coagulase-negative staphylococci )、黄色ブドウ球菌、アクネ菌といった常在細菌が、慢性眼瞼炎の病理経過の原因もしくは寄与因子であることがよく知られている 41,398 。それに対して Gutgesell ら 357 は、閉塞性 MGD の病理組織検査では炎症細胞の浸潤はないかごくわずかなので、細菌感染に起因する炎症は閉塞性 MGD の重要な因子ではないとしている。基本的に 、 細菌感染によるマイボーム腺構造の破壊は、 麦粒腫 のように限局的である。こうした直接的・間接的な細菌感染は MGD の病態発生には重要ではないという報告があるにもかかわらず、リパーゼやトキシンといった細菌の産生物が病態発生に関係しているという意見は根強くある 7,41 。 Dougherty と McCulley 41 は、慢性眼瞼炎の 6 つの患者集団のうちマイボーム腺異常を持つ患者には最も強い細菌性の脂肪分解活性が見られたことを報告している。細菌性リパーゼによって脂質の構成成分が 変化し、涙液層の物理的な性状が影響を受けて、蒸発亢進型ドライアイに至る可能性がある。 MGD の治療に有効な抗生物質は、テトラサイクリン、ドキシサイクリン、ミノサイクリンである 41,399,400 。テトラサイクリンとドキシサイクリンは抗菌効果 が ない用量で用いられるが、ミノサイクリンはその効果のある用量で用いられる。これらの抗生物質は、一般的な処方用量においてリパーゼと炎症を抑制する効果 を持つと考えられている。
ニキビダニ( Demodex )感染が眼瞼炎に関連することがよく知られている 401-403 。こうしたダニ類が MGD の病態発生に関連する可能性については現時点でははっきりしていない 7 。
MGD の病態発生における機能的相互作用
閉塞性 MGD におけるマイボーム腺の構造変化の経過
閉塞性 MGD が臨床的により明白な形をとったものが、涙液油層の不足 2,5,43,407,408 とそれに引き続く涙液蒸発 12 による浸透圧亢進 409-412 および TBUT の短縮 413,414 といった変化からくるドライアイ
症状の発現である 5,6,8,10,12,49,51,261,404-406 。特に、水分不足により摩擦の亢進を伴う機械的刺激 415 、眼表面での炎症カスケードの開始 397,416-418 、視力の不安定化 419 が起こる。これらの結果はおしなべて、眼表面の機能解剖学における複雑な異常調節の現われである 3,15,404,420,421 。さらに、閉塞性 MGD によって瞼板内で腺組織それ自体の萎縮過程が進み、それは組織病理学的に示され、腺脱落として示されると考えられている 10,53,355,362,422,423 。マイボーム腺の萎縮変性の症状はそれほど明白ではなく、マイボグラフィーといったより先進の手法 53,354,413,424-426 を使わない限り、見過ごされがちと思われる。
文献では、 閉塞性 MGD の進行経過( Knop E, et al. IOVS 2009;50:ARVO E-Ab- stract 4833; Knop E, et al. IOVS 2010;51:ARVO E-Abstract 2366 ) 3,6,31,351,354,357,358,377,427 ( Fig.24 ) と、この疾患の 病態 が過角化や マイバム 粘性の病的亢進により開口部と排出導管が閉塞することから始まることが提唱されている。閉塞性 MGD において過角化が原因として関与していることは、 ( 1 ) 臨床的観察から想定され 3 、 ( 2 ) 組織学的観察( Knop E, et al. IOVS 2009;50:ARVO E-Abstract 4833 ) 3,31,357,358 および閉塞した腺から圧出した濃厚 なマイバム の中に角化細胞物質が見られる 3 ことで実証され、 ( 3 ) 患者の圧出した マイバム 中の角化細胞物質の存在 が 分子生物学的および免疫学的分析で示されたことでさらに確実となった( Obata H, et al. IOVS 2002;43:ARVO E-Abstract 60 ) 385 。閉塞性 MGD の動物モデルも、過角化が主要原因であることを支持している 351,354,377 。
眼瞼縁と涙液層へのマイバムの排出が閉塞によって阻害されると、腺房からの分泌は継続して行われるため、マイバムが腺の導管系内に蓄積する 36 。閉塞した腺におけるマイバムの遷延的な蓄積により導管系の内圧が徐々に亢進し、導管系が徐々に拡張していくと考えられる。時間が経つと、亢進した内圧は 細い連結小導管を通じて分泌腺房にも及んでくる。腺房が萎縮変化を起こし、マイボーム腺分泌細胞が消失し 357 ( Fig.18 )、最終的には扁平上皮化生を起こし、導管と腺房の上皮が完全に角化する 31 。腺房の萎縮で続発性の分泌低下が起こり、腺萎縮がマイボーム腺で見られる腺脱落の理由であるとも考えられる。腺萎縮は、マイボーム腺の拡張が瞼板の堅い 結合組織で制限されるので 31 、主に圧迫萎縮として現われるが、細胞分化を阻害する他の因子の関与も考えられる。
マイボーム腺の閉塞性萎縮が明白な炎症を伴わず、炎症性白血球が腺組織に存在することなしに生じることが、ヒトのマイボーム腺拡張について の最初期の組織病理学的記載 31 で言われており、その後の研究で確認されている 3,357,358 。生体共焦点顕微鏡を使った最近の研究 395,396 で、一部の症例で腺房周囲の炎症の存在の可能性が示されているが、この手法では組織病理学に比べて限られた情報しか得られない。急速に増大しつつある眼表 面の免疫学と組織ホメオスタシスの知識 416,428,429 に照らして、少なくとも無症候の炎症反応変化が変性過程に寄与していると仮定することが可能である。炎症反応は刺激性のある脂質種(遊離脂肪酸など)と いった因子 41 、前炎症の下流にある作動物質(ホスホリパーゼ A2 、ロイコトリエン、アラキドン酸 430 など)、そして誘導された炎症性サイトカイン(おそらく MAP キナーゼ 397 や他の経路で誘発されたもの)によって起こる。こうした因子は、皮膚の毛に付属する皮脂腺の閉塞変化(痊瘡)でも言われている 107 。腺構造の拡張と萎縮変化の程度は、閉塞の程度と過程の経過時間に依存すると考えられ、このことは閉塞性 MGD には適切な時期での診断と適切な治療が必要であることを示している 6,389 。 |
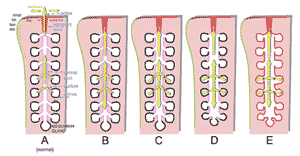 FIGURE 24. Course of structural alterations of the meibomian glands in obstructive MGD. Schematic drawing of a meibomian gland and the posterior lid margin. ( A ) Normal : In the normal meibomian gland, the secretory product (meibum, yellow arrows ) that is produced inside the acini is transported through the connecting ductules into the central duct and is finally delivered through the excretory duct and orifice that is located within the keratinized epidermis ( red ) at the posterior lid border. The ductal system has an incipient stage of keratinization ( pink ). The acini are spherical to elongated, and the connecting ductules are narrow. ( B ) Obstruction: When the orifice and excretory duct are obstructed by hyperkeratinization of the epithelium and/or increased viscosity of the meibum, the delivery of meibum onto the lid margin is reduced or completely inhibited. ( C ) Additional dilatation: The continuing secretion of meibum in the acini generates an increasing pressure inside the glands that leads to a gradual dilatation, first of the central duct. ( D ) Additional atrophy: After a prolonged time, the increased pressure inside the gland leads to dilatation of the connecting ductules and a pressure atrophy of the acini with rarefaction of secretory meibocytes. This effect causes shrinkage of the whole acini that may represent the histopathologic equivalent of the clinically detectable gland dropout and results in a presumed secondary hyposecretion. ( E ) Additional cornification of the glandular epithelium: In late stages the whole ductal epithelium can become cornified and the meibocytes replaced by a stratified squamous cornified epithelium. Reprinted from Knop E, Knop N. [Meibomian glands. Part IV: Functional interactions in the pathogenesis of meibomian gland Dysfunction (MGD).] Meibom-Drüsen, Teil IV: Funktionelle Interaktionen in der Pathogenese der Dysfunktion (MGD). Ophthalmologe . 2009;106:980–987 with the kind permission of Springer Science and Business Media.
FIGURE 24. Course of structural alterations of the meibomian glands in obstructive MGD. Schematic drawing of a meibomian gland and the posterior lid margin. ( A ) Normal : In the normal meibomian gland, the secretory product (meibum, yellow arrows ) that is produced inside the acini is transported through the connecting ductules into the central duct and is finally delivered through the excretory duct and orifice that is located within the keratinized epidermis ( red ) at the posterior lid border. The ductal system has an incipient stage of keratinization ( pink ). The acini are spherical to elongated, and the connecting ductules are narrow. ( B ) Obstruction: When the orifice and excretory duct are obstructed by hyperkeratinization of the epithelium and/or increased viscosity of the meibum, the delivery of meibum onto the lid margin is reduced or completely inhibited. ( C ) Additional dilatation: The continuing secretion of meibum in the acini generates an increasing pressure inside the glands that leads to a gradual dilatation, first of the central duct. ( D ) Additional atrophy: After a prolonged time, the increased pressure inside the gland leads to dilatation of the connecting ductules and a pressure atrophy of the acini with rarefaction of secretory meibocytes. This effect causes shrinkage of the whole acini that may represent the histopathologic equivalent of the clinically detectable gland dropout and results in a presumed secondary hyposecretion. ( E ) Additional cornification of the glandular epithelium: In late stages the whole ductal epithelium can become cornified and the meibocytes replaced by a stratified squamous cornified epithelium. Reprinted from Knop E, Knop N. [Meibomian glands. Part IV: Functional interactions in the pathogenesis of meibomian gland Dysfunction (MGD).] Meibom-Drüsen, Teil IV: Funktionelle Interaktionen in der Pathogenese der Dysfunktion (MGD). Ophthalmologe . 2009;106:980–987 with the kind permission of Springer Science and Business Media.
|
MGD の病態発生における経路の相互作用
中心となるメカニズム 年齢、性別、ホルモン異常、環境因子、さらにはマイバムの構成成分の変化 といった多数の基礎因子が閉塞性 MGD の病態発生に寄与する。こうした因子は、効果的で時宜を得た治療介入が行なわれなければ、一連の事象の中で相互に作用する異なる経路を形成し( Fig.25 )、その過程を強化する複数の悪循環を引き起こす。
閉塞 マイボーム腺の閉塞は MGD の中心的メカニズムとして、以下の 2 つの流れを生み出している。その 2 つともが眼瞼縁と涙液層でのマイボーム腺脂質の量を減少させ、蒸発亢進型ドライアイの状態に至らしめる。 (1) 眼瞼縁への脂質の低排出を介する直接的なもの、および (2) 腺内でのマイバムの停滞により、圧の亢進、そのための拡張、最終的な腺萎縮といった複数の変化が引き起こされ、低分泌を招く間接的なものである。
過角化 MGD の病理経過に影響を与え得るさまざまな内因性・外因性因子( Fig.25 )によって、眼瞼縁とマイボーム腺の上皮の過角化が直接的に、またはもしかすると細胞分化が影響を受けることで、引き起こされる。
過角化が MGD の中心的病理メカニズムとして生じることは、大規模な文献で示されている( Knop E, et al. IOVS 2009;50:ARVO E-Abstract 4833 ) 3,31,351,354,357,358,377 。このことは、マイボーム腺がその胎生発生と構造において睫毛毛包と高い相同性を有しているという事実で説明ができる 26-28 。動物 32 およびヒト 30 のマイボーム腺は、導管上皮の内腔側のいたるところにケラトヒアリン顆粒を形成する初期の角化状態を保持している。本論文で前述したように、こうした観察 結果に基づいて、マイボーム腺は毛幹のない毛包だと見ることができるという言明がなされた 24,431 。したがって、閉塞性 MGD の過角化は、初期角質化が完全な角化に進行するのを防ぐ、
発生上阻害していたものが取り除かれたことによると考えられる。慢性眼瞼炎などの疾患においては、マイボーム腺が毛を発生させる、いわゆる 睫毛重生になることさえある 432,433 。過角化は幹細胞の分化または遊走の異常でも影響を受ける。幹細胞の遊走と分化では一般的に、創傷 434 、およびおそらくは機械的ストレスまたは無症状炎症のメディエータの出現によってより高い可塑度が現われる。毛に付属する皮脂腺においてそうした因子が痊 瘡の発生に影響することが示されている 107 。眼瞼縁およびマイボーム腺の角化を増大させることが分かっている因子はこの他に、薬物の局所 354 または全身 320,435 投与と化学的毒素がある 365 。
加齢とともに、過角化などの変性変化が概して瞼縁後部で増加し、開口部狭窄によりマイボーム腺開口部も損なわれる 348 。腺組織の機能消失であり、腺房萎縮の末期であると考えられるマイボーム腺脱落により、代表的な自覚症状である眼の乾きが起こり、これは加齢とともに強く 進行していく 53 。
マイボーム腺機能へのホルモンの影響も記述が多い。病理変化(特にアンドロゲン作用 406 )によって、眼瞼縁上皮の過角化、眼瞼縁および涙液層のマイバム不足を伴う閉塞性 MGD 、脂質プロファイルの変化、関連するドライアイ症状が引き起こされる 105,257-260 。
粘性の亢進 過角化以外で MGD のもっとも重要な病態発生因子は、マイバムの粘性亢進であり、閉塞性 MGD の全例で認められる 3,4,10,359,385,420,436,437 。これは動物モデルでも見られ 351,354,377 、原発性 258 のものも続発性のものもある。閉塞性 MGD における続発性の変化は、閉塞した腺の導管系内でのマイバム停滞と、起こり得る脂質分解酵素の影響によるものと考えられる。それゆえに、マイバムの停滞は 悪循環の中で閉塞をさらに悪化させることになる。粘性の高いマイバムは、高度角質化した細胞物質との混合物であり、このことは圧出された患者のマイバムの 塗抹サンプル 3 またはインプレッションサイトロジ
インプレッションサイトロジー( Obata H, et al. IOVS 2002;43:ARVO E-Abstract 60 )( Fig.21 )および組織病理学 3,356 で観察され、分子生物学および免疫組織化学 385 でも確認されている。粘性の亢進は動物モデルの閉塞した腺の内部でも観察されている 338 ( Fig.20 )。 |
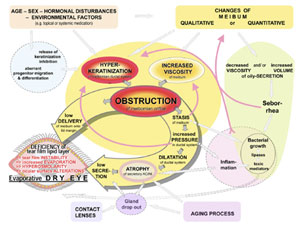
FIGURE 25. Pathways and proposed sequence of events that lead to self-enforcing vicious circles in MGD. Mechanisms and interactions ( arrows ) in MGD occur as a result of underlying causative factors ( colored square boxes located in the periphery). The core mechanisms of gland obstruction due to ductal hyperkeratinization and increased viscosity of the meibomian oil (meibum) are shown in the center of the figure on a yellow underlay and result in two effector limbs (wide shadowed downstream arrows , also on yellow underlay). Associated functional complexes, such as progenitor cell differentiation, bacterial growth, inflammation, and seborrhea, are shown on color-shaded spherical zones around the core mechanisms. Dashed arrows depict likely interactions; functional complexes of likely but insufficiently clarified importance are shown in dashed circles . Vicious circles that result in a progressive process of dysfunction are indicated by red bent arrows . Hyperkeratinization of the epithelium of the excretory duct and orifice is the main factor that leads to obstruction of the meibomian glands. This effect is influenced by endogenous factors such as age, sex, and hormonal disturbances as well as by exogenous factors, such as topical medication. These may act, at least in part, via the release of a physiological inhibition of full keratinization and via an aberrant differentiation of progenitor cells. Increased viscosity of meibum through qualitative changes of its composition is the other important causative factor that contributes to the obstructive process. It may occur independently, because of the influence of endogenous or exogenous factors or a preexisting obstructive stasis of secretum. Obstruction leads on the one hand (left effector limb arrow ) to the immediate clinically observable low delivery of meibum onto the lid margin and tear film that results in an evaporative dry eye condition. On the other hand (right effector limb arrow ), obstruction also results in several consecutive negative effects directly inside the meibomian glands, because of an internal stasis of meibum. Stasis can be associated with increased viscosity of the meibum, which reinforces the obstruction in a vicious circle. The continuous secretory activity of the meibocytes leads to a progressive increase in pressure within the glands. This increased pressure can, in another vicious circle, induce an activation of the epithelial cells that reinforces hyperkeratinization. Pressure further leads to a dilatation, first of the ductal system and, after a prolonged time, also to atrophy of the acini, with rarefaction of their secretory meibocytes, and thus results in a secondary hyposecretion with low secretion of lipids. Atrophy may be the reason for the clinically detectable gland dropout, and CL wear is, by presently unknown mechanisms, associated with gland dropout. Stasis of meibum also promotes the growth of bacteria on the ocular surface and possibly inside the glands, usually pre-existing commensals, that produce lipid-degrading enzymes. Their action on the meibomian lipids leads to the production of toxic mediators, such as free fatty acids, that may initiate subclinical inflammatory reactions with release of inflammatory cytokines. Toxic and inflammatory mediators may promote subclinical inflammatory events inside the gland, in the periglandular conjunctiva, on the lid margin, and on the ocular surface, as suggested by observations in dermatology (e.g., in acne pathogenesis and skin irritation). Toxic mediators are also assumed to have negative effects on tear film stability. Furthermore, they can lead to qualitative changes in the composition of meibum that increase its viscosity or, through activation of epithelia on the lid margin and possibly inside the gland, they can reinforce keratinization. Altogether, these events can give rise to several vicious circles ( red arrows ) that increase the preexisting obstruction, if not limited by timely diagnosis and therapeutic intervention. There is evidence from a mouse model that acinar atrophy may also occur due to the aging process. If MGD occurs in conjunction with systemic skin diseases such as seborrheic dermatitis, possibly accompanied by blepharitis, an increased amount of oil (seborrhea) with decreased viscosity can be observed on the lid margin. Seborrheic blepharitis, similar to stasis, can be associated with increased bacterial growth and its downstream negative effects. The seborrheic oil has a different composition than that of normal meibum and thus may have negative effects on the tear film. All major mechanisms of the schematically depicted process are supported by findings in the literature. Reprinted from Knop E, Knop N. [Meibomian glands, Part IV: functional interactions in the pathogenesis of meibomian gland dysfunction (MGD).] Meibom-Drüsen, Teil IV: Funktionelle Interaktionen in der Pathogenese der Dysfunktion (MGD). Ophthalmologe . 2009;106:980–987 with the kind permission of Springer Science and Business Media. |
加齢はホルモン変化を伴い、極性および中性脂質のプロファイルが変化するように、脂質の構成成分が変化する頻度も高くなる 105 。慢性眼瞼炎の患者で見られる一価不飽和脂肪酸、特にオレイン酸の減少のように、脂質の質的変化によってマイバムの粘性亢進が起こり得る 438 。脂質の不飽和度が減少すると融点が上がり、それゆえ濃厚化するので 407 、この現象は閉塞過程を促進することになり、眼瞼炎で閉塞率が高いことを説明できる。涙液表層の非極性脂質が涙液水層に接着するのを維持すると考えられて いる 2,102,439 極性脂質の消失は、 MGD 患者の涙液層を不安定にし、蒸発量を増やすことに寄与していると考えられる。 関連する機能複合体 マイボーム腺の導管と開口部の過角化にマイバムの粘性亢進が合わさることで起こる閉塞過程としての MGD の中心メカニズムとは別に、病態発生において相互作用する機能複合体がいくつかある。
細胞分化の変化 マイボーム腺または眼瞼縁にある幹細胞と前駆細胞の分化異常は、内因 性・外因性の基礎因子(年齢、性別、ホルモンレベルなど)で起こり得る。導管の細胞ではこうした変化によって過角化(前述)が起こり、それが腺房細胞の脂 質プロファイルの変化に寄与する。細胞分化の変化はまた一般的に、ヒトの加齢プロセスにも関わっていると考えられ、マウスの腺房萎縮で示されている 87 。異常な細胞分化は、マイボーム腺の全般的な病理的変化に関与している。
脂漏 マイボーム腺も含めた眼瞼縁での疾患状態は、前部眼瞼炎と後部眼瞼炎、または MGD といった用語の明快な区別がまだつけられていなかったので、単に眼瞼炎( blepharitis )と長い間呼ばれてきた 6,7 。 McCulley ら 394 は、眼瞼炎の中に脂漏型のものが大きな割合を占めていることを報告した。これらの患者の大半は、全身性の皮膚疾患、主に脂漏性皮膚炎を伴っており、皮脂腺 の多い皮膚領域に病変があった。その部分は、常ではないが、低粘性の脂質が大量にあることが多く、一般的に過角化も伴っていた 440 。このことは、脂漏性皮膚炎に過角化した閉塞性 MGD が伴うことがあることの説明の一助になる。脂漏によって、マイバムの質的・量的変化と上皮の過角化を促進する複数のフィードバックメカニズムが発動すると 考えられている。痊瘡においては、皮脂産生の増大によって皮脂腺の閉塞疾患が促進されることが知られている 148 。慢性眼瞼炎と脂漏を持つ患者の脂質の構成成分には、一価不飽和脂肪酸の量が増大するといった質的変化が観察されている。一価不飽和脂肪酸が増大すると融 点が下がり、それがこの病態において眼瞼縁が油っぽくなることの理由である 438 。脂漏性眼瞼炎では、閉塞性 MGD と同じく、細菌増殖が亢進し、その結果、細菌の脂質変性酵素がやはり存在する。それにより脂質の構成成分が変化し、それに続く毒性メディエータの効果のた めに、組織、さらにおそらく涙液層に負の影響が起こる 398 。したがって、眼瞼炎の病態発生において細菌増殖を伴う脂漏と無症候性炎症とを関連づけることが可能である。眼瞼炎と MGD の各サブタイプの定義については、「定義と分類」の報告書参照のこと。
細菌の影響:常在細菌の増殖 MGD には眼瞼縁に存在する細菌の増殖を伴うことがあるが、閉塞した導管系の中も、完全に栄養が揃った安定した理想的な棲息場所になっていると考えられる。慢性 眼瞼炎患者と健常対照者の細菌学的評価でもっとも頻繁に分離できた微生物は、常在細菌、特に黄色ブドウ球菌、コアグラーゼ陰性ブドウ球菌、脂溶性コリネバ クテリウム属、アクネ菌であり、眼瞼炎の 98 %で培養陽性だった 42 。同様の菌種は、滅菌綿棒で眼瞼縁を洗浄後に新たに圧出したマイバムサンプルの 52 %から培養された 42 。この手法では、圧出されたばかりのマイバムが眼瞼縁の細菌に汚染されたという可能性を完全に排除することはできないが、この研究の所見は、常在細菌もマ イボーム腺の中に普通に存在するということを強く示すものである。こうした細菌のコロニー形成は感染を意味するのではなく、すでに存在していた常在細菌の 増殖を意味することに留意する必要がある 42,353 。眼瞼炎の脂漏グループ全員に高度の MGD が伴っていたという観察結果 394 を受けて、脂質の異常はこの疾患の原因のひとつであるという仮説が立てられた。のちの研究では、あらかじめ 培養されていた細菌が、その脂質分解酵素(リパーゼとエステラーゼ) 41 でマイボーム腺の脂質を分解でき、正常なマイボーム腺脂質を改変して、脂質スペクトルを変化させることが観察されている 441 。この分解の影響により、一部の遊離脂肪酸に顕著な変化が起きる。遊離脂肪酸は上皮を刺激し、表皮バリアを貫通して、炎症と過角化を起こすことが知られて いる 386 。遊離脂肪酸は皮脂腺の痊瘡の閉塞疾患を促進する因子であることも知られている 107,442,443 。特に遊離脂肪酸と脂肪酸アルコールが慢性眼瞼炎に顕著に寄与していると思われ、それが上皮を刺激し、角化を促進すると考えられる 444,445 。コレステロールエステラーゼ活性によって、利用できるコレステロールが増えることでさらに細菌の増殖が促進される 444 。常在細菌の増殖の促進とそれに続く刺激性脂質と毒性メディエータの存在は、 MGD に影響する因子として認識しなければならない。こうした因子は、閉塞性 MGD の主原因ではないだろうが、すでに存在する閉塞と鬱帯ゆえに重大なものとなる続発現象である。細菌の増殖は、過角化を悪いほうに増強し、マイバムの質的・ 量的変化において作用していると考えられる。
炎症メディエータ 細菌増殖の増大は、遊離脂肪酸といった脂質を放出し、それが組織を刺 激して炎症誘発の形で作用し、おそらくは涙液層にも作用することを通じて無症候性の炎症変化につながる 41 。眼瞼炎患者のマイバムではホスホリパーゼ A2 の量が増加していた 446 。ホスホリパーゼ A2 の量が増えると、不飽和脂肪酸のひとつであるアラキドン酸の生成が誘導され、それを基にプロスタグランジンとロイコトリエンが合成される。これらの因子は 炎症過程において中心的な位置を占める。これらは眼表面の上皮を刺激して活性化させ、また、涙液層の不安定性ももたらすと考えられている 41,445 。活性化した上皮細胞は次に、 TNF-α 、 TNF -β やインターロイキン -α 、インターロイキン -β といった炎症性サイトカインを産生し、無症候性炎症の微小環境を進展させる 4,41,407,430,447,448 。こうした炎症性サイトカインは正常な皮脂腺細胞およびストレスを受けた皮脂腺細胞によっても産生される 148,449,450 。 Zouboulis 151 が論じたように、分離した毛包脂腺系に in vitro で IL-1-α を加えると過角化 451 が起こる。同様の変化は皮膚の毛包脂腺の閉塞性疾患(痊瘡)でも観察されることを、 Kurokawa ら 107 が論じている。痊瘡では 3 つの典型的な事象が起こる。第 1 として、脱飽和した脂肪酸や過酸化脂質、それに眼瞼縁にも存在するアクネ菌といった常在細菌も上皮細胞の炎症性サイトカイン産生を誘発する 452 。第 2 として、 IL-1α などの炎症性サイトカインは上皮細胞を活性化して、正常上皮細胞の分化を変化させて、増殖と角化を亢進させる方向に誘導する 453 。これも合わさって、閉塞性脂腺疾患を起こす。第 3 として、マイボーム腺脂質の病的変化の時に現われる過酸化脂質などの過酸化物が、細胞の成熟と脂質産生を促進する転写因子 PPAR-γ に対するリガンドとして働く。以上の作用が、痊瘡の脂漏だけでなく、 MGD を伴う脂漏性眼瞼炎にも寄与していると考えられる。
生理的加齢過程 生理的な加齢変化であるのかもしれないヒトのマイボーム腺の加齢 依存性の変性が、様々な研究で示されている。ヒトでは、過角化やマイボーム腺開口部狭窄を含む変性変化 348 が一般的に加齢とともに瞼縁後部で強まり、それが閉塞性 MGD を誘発すると考えられている。加齢によって、マイバムの構成成分も変化し、それは前述のように極性および中性脂質プロファイルの変化に現われる 105 。閉塞性 MGD は、 20 歳から 80 歳の間で分泌している活動腺が半数に 減るという事に関与している可能性 50 、同様に、同じ年齢枠において観察され、いろいろな眼乾燥の症状を引き起こす機能腺組織の劇的な消失(腺脱落) 53 に関与している可能性もある。 CL 装用が、加齢過程の亢進によく似た変化を引き起こすことが分かっている 355 が、そうした原因が腺脱落を起こさせる正確な病理メカニズムはまだ不明である。
閉塞に続発して起こるマイボーム腺の変化とは別に、加齢依存性の変化が腺組織の生理に直接的に影響を与えるこ との指標がある 387 。 Nien ら 87 は、マウスモデルで、腺房の萎縮性変化という意味での腺機能の減少を、皮脂腺の分化と成熟にとって不可欠な因子の変化をみたり、複数の指標を観察した。高 齢動物では、マイボーム腺の有糸分裂が顕著に減少し、それに並行して腺房の縮小、マイボーム腺細胞の成熟マーカーである PPAR-γ の局在場所の変化、脂質産生の減少が見られた。こうした変化は、明らかに腺の閉塞と過角化を伴わずに生じた。閉塞性 MGD の病理とは対照的に、腺組織に骨髄由来細胞の増加が見られ、これは細胞性免疫反応の現われと考えられている。
以上の知見から、身体の他の器官と同じように、マイボーム腺も原発性の加齢依存型の変性を起こし、それによ り、続発性の病的状態の閉塞性 MGD とは対照的に腺機能が徐々に低下していくことが想定される。マウスモデルによると 87 、腺房の萎縮変化は明らかに導管および開口部の過角化と閉塞を伴っていなかった。後者の現象は、原発性の加齢依存性変性と、閉塞性 MGD による病的な萎縮性破壊との鑑別基準として有用なものになる可能性がある。その一方で、マウスのこうした萎縮性変化はヒトの典型的な病変とは似ていないの で、ヒトでの典型的な状況に比較して、種特異的な違いも現わしている可能性もある。
CL 装用 CL 装用は、 MGD に関連する環境因子として広範囲に存在するもののひとつである 454 。閉塞性 MGD を CL 不耐患者における原因として記述したのは Korb と Henriquez 3 が初めてだが、その後の複数の研究では、 CL 装用がない場合 389 に比較して CL 装用が閉塞性 MGD と関連性があるという点について、はっきりとした結果はでていない 359,436,454-457 。その一方で、 Paugh ら 436 が見いだした眼瞼を清潔にするという MGD 治療が、同様の患者の CL 不耐を改善するのに有効だった。 Ong と Larke 458 の報告によれば、 CL 装用を始めることで、レンズの種類に関係なく、腺の閉塞と異常マイバムを伴う MGD の率が上昇した。彼らは後の研究 359 で、 CL 装用では MGD 有病率がわずかに上昇するに過ぎないと報告している。 Mathers と Billborough 388 の明白なデータによれば、 CL 関連の巨大乳頭結膜炎の患者は MGD 有病率がはっきりと高く、マイバムの濃厚化と腺脱落が見られることから、 MGD の病態発生において炎症メディエータの関与の可能性が考えられる。 Arita ら 355 による最近のデータでは、 CL 装用者にはドライアイ症候群を伴う腺脱落が高い率で見られることが示された。脱落はレンズ装用期間と相関していたが、レンズの種類には関係しなかった。 30 歳代前半のこれらの患者の腺脱落率はすでに、正常な 80 歳の集団に匹敵するほどであり 53 、したがって CL 装用はマイボーム腺の自然の加齢過程を加速すると結論づけられた。このように、 CL 装用は MGD という意味でのマイボーム腺の変化と関連していると考えることができるが、その正確な病理メカニズムはまだ不明であり、今後の解明が待たれる。 |
|
|
|
|
| |
|
 |
|